
【题目】已知反应:2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
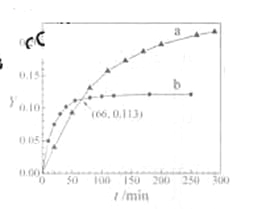
A. b代表![]() 下CH3COCH3的Y-t曲线
下CH3COCH3的Y-t曲线
B. 反应进行到20min末,H3COCH3的![]()
C. 升高温度可缩短反应达平衡的时间并能提高平衡转化率
D. 从Y=0到Y=0.113,CH3COCH2COH(CH3)2的![]()
【答案】D
【解析】
试题A、温度越高反应速率就越快,到达平衡的时间就越短,由图象可看出曲线b首先到达平衡,所以曲线b表示的是20℃时的Y-t曲线,A错误;B、当反应进行到20min时,从图象中可以看出b曲线对应的转化分数高于a曲线对应的转化分数,这说明b曲线在20℃时对应的反应速率快,所以v(0℃)/v(20℃)<1,B错误;C、根据图象温度越高CH3COCH3转化的越少,说明升高温度平衡向逆反应方向进行,即正方应是放热反应,C错误;D、根据图象可以看出当反应进行到66min时a、b曲线对应的转化分数均相同,都是0.113,这说明此时生成的CH3COCH2COH(CH3)2一样多,所以从Y=0到Y=0.113,CH3COCH2COH(CH3)2的△n(0℃)/△n(20℃)=1,D正确,答案选D。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
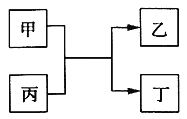
下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普洱茶具有独特的香气,是云南的旅游名片之一。橙花叔醇是影响其香气的物质之一,结构如图所示。下列说法正确的是
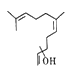
A. 该物质的化学式是C15H26O
B. 该物质不能使酸性高锰酸钾溶液褪色
C. 该物质的同分异构体可以是芳香族化合物
D. 该物质可以发生加成反应,不能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列方程式:
(1)电离方程式
①Al2(SO4)3__________;
②NH3·H2O_____;
③BaSO4_____;
④NaHSO4(水溶液)______;
⑤H2S______;
(2)离子方程式
①碳酸氢钠溶液和氢氧化钠溶液反应__。
②用稀硫酸清洗铁锈__。
③向足量澄清石灰水中通入二氧化碳___。
④硫酸与氢氧化钡溶液反应___。
⑤碳酸氢钠溶液与少量的氢氧化钙溶液反应___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.35克二氧化锰与50mL12mol/L浓盐酸反应生成标准状况下氯气______升?将反应后所得的溶液稀释至1L,从中取出25mL,加足量的硝酸银溶液,可得沉淀_______克?(MnO2+4HCl![]() MnCl2++Cl2↑+2H2O)
MnCl2++Cl2↑+2H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁与4mol·L-1的稀硫酸反应(放热反应)生成H2的物质的量与反应时间的关系如图所示。下列结论正确的是

A.反应开始2min内平均反应速率最大
B.常温下,改用98.3%的浓硫酸可以加快反应速率
C.反应在2~4min间生成H2的平均反应速率为0.1mol·L-1·min-1
D.2~4min内反应速率逐渐增大,说明2~4min内温度比浓度对反应速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上广泛采用氨和二氧化碳高温高压下制备尿素,主要反应为两步:
第一步:生成氨基甲酸铵 | 第二步:氨基甲酸铵脱水生成尿素 |
2NH3(l)+CO2(g) | H2NCOONH4(l)
|
快速放热 | 慢速吸热 |
(1)写出制备尿素的总反应化学方程式:____________________________,该反应热为![]() ,则
,则![]() ______________(“大于”“小于”或“等于”)
______________(“大于”“小于”或“等于”)![]() 。
。
(2)下列说法正确的是________________。
A.利用二氧化碳制备尿素是减缓温室效应的有效方法
B.第二步反应高温条件下自发进行
C.提高投料中的水碳比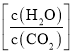 有利于尿素的生成
有利于尿素的生成
D.第一步反应的活化能大于第二步反应
(3)尿素生产过程中转化率通常用二氧化碳转化率来表示,当二氧化碳起始浓度为![]() 时(
时(![]() ,水碳比=0.5),尿素平衡转化率随氨碳比
,水碳比=0.5),尿素平衡转化率随氨碳比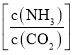 的变化如表所示:
的变化如表所示:
氨碳比/浓度比 | 2.95 | 3.10 | 3.20 | 3.50 |
尿素平衡转化率/% | 56.4 | 57.5 | 57.9 | 60.0 |
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于反应正向移动;二是_____________。氨碳比为3.50时,求该状态下的制备尿素总反应平衡常数K=___________.
(4)一定条件下,在图中绘制氨基甲酸铵(![]() )在反应过程中物质的量与时间的关系图。
)在反应过程中物质的量与时间的关系图。
 _______________
_______________
(5)通过直接尿素燃料电池装置,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:____________________________.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。
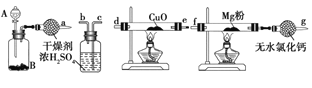
①A中盛装的是浓氨水,B中可盛装___,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接___、___接___、___接___。
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为____________________。
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为____________________。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_____。
②步骤3中加氨水后反应的离子方程式为______________。
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
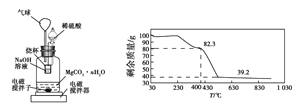
③图中气球的作用是__________________。
④上述反应后期要升温到30 ℃,主要目的是________________。
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为___(用含a的表达式表示)。
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com