
| A. | v(A)=0.4mol•L-1•s-1 | B. | v(B)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.9 mol•L-1•s-1 | D. | v(D)=1 mol•L-1•s-1 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )
298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )| A. | 298K 时,0.1mol•L-1HX 溶液中HX的电离度为1% | |
| B. | V=10mL时,同时微热溶液(忽略体积变化),$\frac{c({X}^{-})}{c({Y}^{-})}$逐渐增大 | |
| C. | V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-) | |
| D. | 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
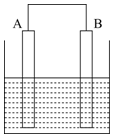
| A. | 导线中有电子流动,电流方向为A流向B | |
| B. | 溶液中的O2在电极B得电子,电极B附近碱性增强 | |
| C. | 电极A上的电极反应式为Fe-2e-=Fe2+ | |
| D. | 溶液中的Na+向电极B附近移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | C-H | H-H | C≡C |
| 键能/kJ•mol-1 | 413.4 | 436 | 812 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 道尔顿:分子学说 | B. | 汤姆生:射线的发现 | ||
| C. | 卢瑟福:原子结构的行星模型 | D. | 伦琴:原子的葡萄干面包模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备硫酸:使用热交换器可以充分利用能量 | |
| B. | 侯德榜制碱:析出NaHCO3的母液中加入消石灰,可以循环利用NH3 | |
| C. | 合成氨:采用500℃的高温,有利于增大反应正向进行的程度 | |
| D. | 合成氯化氢:通入H2的量略大于Cl2,可以使平衡正移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com