
【题目】从镍矿石尾矿中提取NiSO4是解决我国镍资源匮乏的一条重要途径,已知该过程如下:
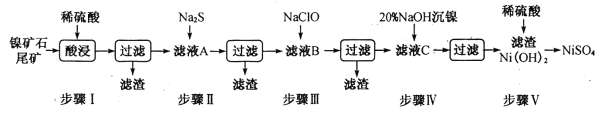
表1:各物质的Ksp数据如下表:
物质 | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5×10-13 | 1.1×10-21 | 8.0×10-28 | 6.3×10-36 | 2.0×10-15 |
表2:滤液A中各金属离子的含量如下表:
成分 | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | …… |
含量/g·L-1 | 3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | …… |
根据以上信息,回答下列问题:
(1)步骤I酸浸之前需将矿石粉碎,目的是_______________。
(2)
(3)常温下进行步骤Ⅲ的目的是为了除去铁和锰元素,已知除铁元素的离子反应如下:2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl- +4H+,此时Mn2+的氧化产物为MnO2,写出除锰元素的离子方程式_____________。
(4)所得Ni(OH)2是制造镍镉电池的重要原料,镍镉电池工作原理如下:Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2,则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______________________。
Cd(OH)2+2Ni(OH)2,则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______________________。
【答案】增大接触面积,提高浸取率 8.0×l0-23 否 Mn2+ +ClO-+H2O =MnO2↓+Cl- +2H+ 增大 Cd(OH)2 +2e-=Cd+2OH-
【解析】
(1)矿石粉碎的目的是增大接触面积,提高浸出率;
(2)根据溶度积进行计算和判断;
(3)Mn2+的氧化产物是MnO2,说明Mn2+作还原剂,ClO-作氧化剂,本身被还原成Cl-,然后利用化合价升降法进行配平;
(4)根据电解原理进行分析;
(1)步骤I酸浸之前,需要将矿石粉碎,可以增大接触面积,提高浸取率;
答案为增大接触面积,提高浸取率;
(2)若杂质离子的浓度c≤1.0×10-5mol/L即可认定沉淀完全,步骤II中Pb2+恰好沉淀完全,此时溶液中c(S2-)=![]() =8.0×10-23mol·L-1;加入滤液的体积为1L,此时溶液中c(Ni2+)=
=8.0×10-23mol·L-1;加入滤液的体积为1L,此时溶液中c(Ni2+)=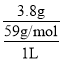 ≈0.06mol·L-1,即有Qc=0.06×8.0×10-23=4.8×10-24<1.1×10-21,说明Ni2+还没有沉淀;
≈0.06mol·L-1,即有Qc=0.06×8.0×10-23=4.8×10-24<1.1×10-21,说明Ni2+还没有沉淀;
答案为8.0×10-23mol·L-1;否;
(3)Mn2+的氧化产物是MnO2,即Mn2+作还原剂,ClO-作氧化剂,其还原产物应是Cl-,则有Mn2++ClO-→MnO2↓+Cl-,利用化合价升降法进行配平,得出Mn2++ClO-→MnO2↓+Cl-,然后利用原子守恒以及所带电荷数守恒,得到:Mn2+ +ClO-+H2O =MnO2↓+Cl- +2H+;
答案为Mn2+ +ClO-+H2O =MnO2↓+Cl- +2H+;
(4)放电是电池工作,其正极反应式为:NiOOH+H2O+e-=Ni(OH)2+OH-,正极区的c(OH-)增大,即pH增大;充电属于电解池,阴极上得到电子,即阴极反应式为Cd(OH)2+2e-=Cd+2OH-;
答案为增大;Cd(OH)2+2e-=Cd+2OH-。


科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,![]() 与
与![]() 的混合气体中含有分子总数为
的混合气体中含有分子总数为![]()
B.![]() 羟基
羟基![]() -OH
-OH![]() 和1mol甲基
和1mol甲基![]() -CH3
-CH3![]() 中含有的电子数均为
中含有的电子数均为![]()
C.a mol苯乙烯![]()
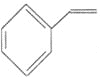
![]() 中含有C-H键的数目为
中含有C-H键的数目为![]()
D.![]() 与浓硫酸完全反应,生成气体的分子数为
与浓硫酸完全反应,生成气体的分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A.1mol硝基![]() 与46g二氧化氮
与46g二氧化氮![]() 所含的电子数均为
所含的电子数均为![]()
B.![]() 液与
液与![]() 溶液中的
溶液中的![]() 数目相同
数目相同
C.标准状况下,![]() 三氯甲烷中含碳氯共价键的数目为
三氯甲烷中含碳氯共价键的数目为![]()
D.向FeI2溶液中通入适量![]() ,当有
,当有![]() 被氧化时,转移的电子数为
被氧化时,转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,22.4L SO3含NA个分子
B.含0.4mol HCl的浓盐酸与足量二氧化锰反应转移电子数为0.2NA
C.32gCu与足量硫完全反应,转移的电子数为0.5NA
D.在200mL 5mol·L-1 AlCl3溶液中,Al3+数目为NA,等于Cl-数目的1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数,下列叙述正确的是
为阿伏加德罗常数,下列叙述正确的是![]()
![]()
A.过氧化钠与水反应时,生成![]() 转移的电子数为
转移的电子数为![]()
B.![]() 用NaOH溶液充分吸收,转移的电子数目为
用NaOH溶液充分吸收,转移的电子数目为![]()
C.常温常压下,![]() 和
和![]() 混合,生成气体分子数目为
混合,生成气体分子数目为![]()
D.常温常压下,![]() 与足量的铁屑反应转移电子数目为
与足量的铁屑反应转移电子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2A(g)+2B(g)![]() C(g)+2D(g),在容器均为2L的甲,乙,丙三个恒温(反应温度分别为300℃,T℃,300℃)容器中分别加入物质的量之比为1:1的A和B,测得各容器中n(B)随反应时间t的变化情况如下表所示:
C(g)+2D(g),在容器均为2L的甲,乙,丙三个恒温(反应温度分别为300℃,T℃,300℃)容器中分别加入物质的量之比为1:1的A和B,测得各容器中n(B)随反应时间t的变化情况如下表所示:
0 | 40 | 80 | 120 | 160 | |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
根据表中数据,下列说法正确的是
A.乙容器中的反应温度T<300
B.丙容器中,0-40min内用A的浓度变化表示的平均反应速率为为0.05mol/(L·min)
C.若起始时向甲容器中加入0.2、0.2、0.4和1.2,则反应将向正反应方向进行
D.在0-40min内,提高乙容器中的A的转化率的有效途径是使用高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如图1:
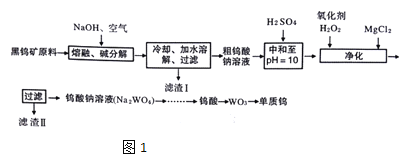
已知:
①滤渣I的主要成份是Fe2O3、MnO2
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为___,请写出MnWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式___
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为___,滤渣Ⅱ的主要成分是___
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图2为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
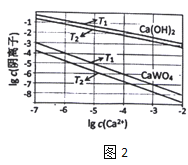
①T1___T2(填“>”或“<”)T1时Ksp(CaWO4)=___
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图分别是A、B两种物质的核磁共振氢谱,已知A、B两种物质都是烃类,都含有6个氢原子,试根据两种物质的核磁共振氢谱推测A、B有可能是下面的
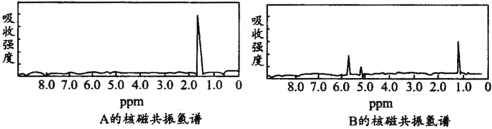
A.C3H6,C6H6B.C2H6,C3H6C.C6H6 ,C2H6D.C3H6,C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-lg[c(H+)/c(H2C2O4)]和-lgc(HC2O4-)或-lg[c(H+)/c(HC2O4-)]和-lgc(C2O42-)关系如图所示,下列说法错误的是( )

A. Ka1(H2C2O4)=1×10-2
B. 滴定过程中,当pH=5时,C(Na+)-3C(HC2O4-)>0
C. 向1 mol/L的H2C2O4溶液中加入等体积等浓度的NaOH溶液,完全反应后显酸性
D. 向0.1 mol/L的H2C2O4溶液中加水稀释,C(HC2O4-)/C(H2C2O4)比值将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com