
| A.采用加热分解法冶炼金属钾 | B.采用电解法冶炼金属铝和钠 |
| C.采用热还原法冶炼金属铁与汞 | D.采用热还原法冶炼金属铜与钙 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.为了提高含氮量,可以不必考虑施用过程中化肥对土壤产生的不良影响 |
| B.碳铵化肥可以和碱性草木灰混合使用 |
| C.为增强作物的抗寒、抗旱能力,可以适当地施用一些磷肥 |
| D.使用了某一效果显著的杀虫剂后,可以不必更换品牌长期使用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸收塔中SO3从下而上,剩余气体从上部出来放空 |
| B.目前合成氨,没有采用更高温度、更大压强是从设备和动力要求方面考虑的 |
| C.制普通玻璃的主要原料是纯碱、石灰石、石英 |
| D.生产硫酸时,接触室内热交换器的作用是预热进入的炉气和冷却反应生成的气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
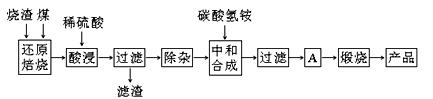
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
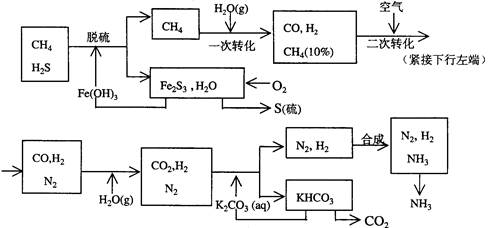
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 验方法是 。
验方法是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
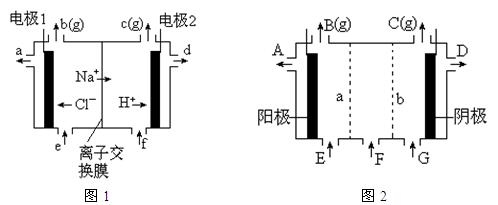
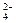 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO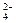 ,该钡试剂可以是 ▲ 。
,该钡试剂可以是 ▲ 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com