
水(H2O)在很多化学反应中具有极其重要的作用。请研究下列水参与的氧化还原反应。
①NaH+H2O==NaOH+H2↑
②2Na2O2+2H2O==4NaOH+O2↑
③Na+2H2O==2NaOH+H2↑
④3NO2+H2O==2HNO3+NO
⑤2H2O 2H2↑+O2↑
2H2↑+O2↑
⑥2F2+2H2O==4HF+O2
(1)水只作氧化剂的是________;水只作还原剂的是________;水既作氧化剂,又作还原剂的是________;水既不作氧化剂,又不是还原剂的是________。
(2)水作氧化剂时,被还原的元素是________,水作还原剂时,被氧化的元素是________。
(3)写出化学方程式②的离子方程式________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在_________部分发生反应,在______部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为_________;加入硅、锰和铝的目的是_______。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹_______(填“前”或“后”)加入,原因是_____________。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是_________。从环保和经济角度考虑,上述尾气经处理可用作________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A题适用于二期课改新教材,B题适用于一期课改教材。
(A)我国化学家候德榜(右下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
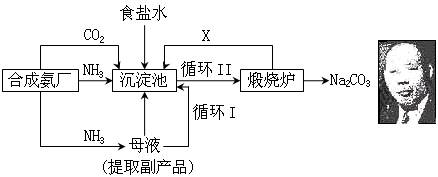
(1) 上述生产纯碱的方法称 ,副产品的一种用途为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3) 写出上述流程中X物质的分子式 。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(B)某化学课外小组用下图装置制取溴苯。

先向分液漏斗中加入苯和液溴 ,再将混合液慢慢滴入反应器A(A下端活塞)中。
(1)写出A中反应的化学方程式 
(2)观察到A中的现象是 。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
(4)C中盛放CCl4的作用是 。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,盐酸既表现出还原性又表现出酸性的是( )。
A.CaCO3+2HCl==CaCl2+H2O+CO2↑
B.Fe+2HCl===FeCl2+H2↑
C.MnO2+4HCl (浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.NaOH+HCl==NaCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三个氧化还原反应:
(1)2FeCl3+2KI==2FeCl2+2KCl+I2
(2)2FeCl2+Cl2==2FeCl3
(3)2KMnO4+16HCl (浓)==2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+和I―共存,要除去I―而又不影响Fe2+和Cl―,可加入的试剂是( )。
A.Cl2 B.FeCl3 C.KMnO4 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性是顺序为SO2 > I- > Fe2+ > H2O2> Cl-,则下列反应不可能发生的是( )
A.2Fe2++Cl2=2Fe3++2Cl-
B.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
C.H2O2+H2SO4=SO2↑+O2↑+2H2O
D.SO2+I2+2H2O=H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应最终能生成Fe3+的化合物的是( )
①过量Fe与HNO3 ② 铁丝在硫蒸汽中燃烧 ③向FeBr2溶液中通入Cl2 ④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中
A.①②③ B.①③⑤ C.③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
用石墨做电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况( )
A.CuSO4 B.CuO
C.Cu(OH)2 D.CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述中正确的是
A.CS2分子的立体构型为V形
B.ClO 的空间构型为平面三角形
的空间构型为平面三角形
C.SF6中有每个原子均满足最外层8电子稳定结构
D.SiF4和SO 的中心原子均为sp3杂化
的中心原子均为sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com