
【题目】如图所示三套实验装置,分别回答下列问题. 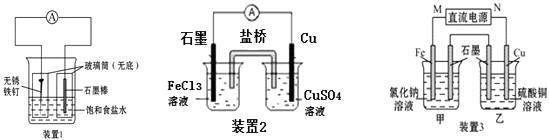
(1)装置1为铁的吸氧腐蚀实验.一段时间后,向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,则该装置中石墨电极的反应式为 .
(2)装置2中的铜是极(填“正”或“负”),该装置中石墨电极所发生的反应为 .
(3)装置3中甲烧杯盛放100mL 0.2molL﹣1的NaCl溶液,乙烧杯盛放100mL0.5molL﹣1的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①甲烧杯中铁为极;甲烧杯中石墨电极的电极反应式为 .
②乙烧杯中电解反应的离子方程式为 .
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64g,甲烧杯中产生的气体在标准状况下的体积为mL.
【答案】
(1)O2+2H2O+4e﹣═4OH﹣
(2)负极;Fe3++e﹣=Fe2+
(3)阳极;2H2O+2e﹣=H2↑+2OH﹣或2H++2e﹣═H2↑;2Cu2++2H2O ![]() 2Cu+O2↑+4H+;224
2Cu+O2↑+4H+;224
【解析】解:(1)铁发生吸氧腐蚀,正极发生还原反应,氧气得到电子被还原生成OH﹣ , 电极方程式为O2+2H2O+4e﹣═4OH﹣ , 所以答案是:O2+2H2O+4e﹣═4OH﹣;(2)铜可被Fe3++氧化,发生Cu+2Fe3+=Cu2++2Fe2+ , 形成原电池反应时,铜为负极,发生氧化反应,石墨为正极,正极反应为Fe3++e﹣=Fe2+ , 所以答案是:负; Fe3++e﹣=Fe2+;(3)乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,①向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成OH﹣ , 应为电解池的阴极,则M为正极,N为负极,铁为阳极,电解氯化钠溶液,阴极发生还原反应生成氢气,电极方程式为2H++2e﹣═H2↑,所以答案是:阳; 2H2O+2e﹣=H2↑+2OH﹣或2H++2e﹣═H2↑;②乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,电解方程式为2Cu2++2H2O ![]() 2Cu+O2↑+4H+ , 所以答案是:2Cu2++2H2O
2Cu+O2↑+4H+ , 所以答案是:2Cu2++2H2O ![]() 2Cu+O2↑+4H+;③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为
2Cu+O2↑+4H+;③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为 ![]() =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
甲烧杯中,阳极铁被氧化,阴极产生气体为氢气,
2H2O | + | 2e﹣ | ═ | 2OH﹣ | + | H2↑ |
2mol | 22.4L | |||||
0.02mol | V |
V= ![]() =0.224L,即224mL,
=0.224L,即224mL,
所以答案是:224.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在体积为V L的密闭容器中通入amolCO和bmolO2,一定条件下反应后容器内碳原子数和氧原子数之比为
A. a︰b B. a︰2b C. a︰(a+2b) D. a︰2(a+2b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能提高合成氨[N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol]厂的生产效率和经济效益的是
2NH3(g) ΔH=-92.4 kJ/mol]厂的生产效率和经济效益的是
①采用20 MPa~50 MPa的压强;②使用催化剂;③在合适的温度下进行反应;④从平衡混合气体中液化分离出NH3,并将N2、H2循环使用
A. ①③④ B. ③④ C. ①②③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
A. ②④⑥ B. ③⑤⑥ C. ①②④ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)![]() 3B(?)+C(?);达到平衡时,混合气体的平均相对分子质量
3B(?)+C(?);达到平衡时,混合气体的平均相对分子质量![]() 与温度的关系如图所示,下列判断中正确的是
与温度的关系如图所示,下列判断中正确的是
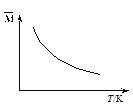
A. 若正反应吸热,则B、C可能都是气体
B. 若正反应吸热,则B、C一定都是气体
C. 若正反应放热,则B、C一定都是气体
D. 若正反应放热,则B、C可能都是固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空: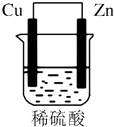
(1)为正极,发生反应(“氧化”或“还原”),现象是 , 电极反应式为;为负极,发生反应(“氧化”或“还原”),现象是 , 电极反应式为 .
(2)H+向极移动,电子流动方向为→导线→(填电极材料)
(3)若锌片只发生电化学反应,则当铜片上共放出3.36L(标准状况)气体时,H2SO4恰好完全消耗.求:
①反应中消耗的锌的质量
②有个电子通过了导线.
③原稀H2SO4的物质的量浓度是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com