
����Ŀ��CPAE�Ƿ佺����Ҫ���Գɷ֣����п��������ã��˹��ϳ�CPAE��һ��·�����£�
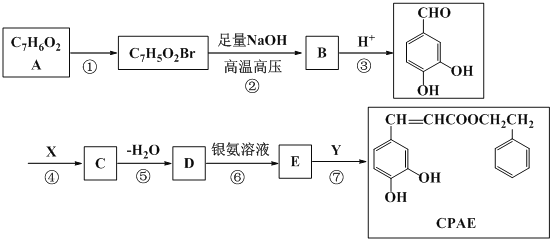
��֪��i��A�����б�����һ�����ֻ��2�֣�
ii��R1��CHO+R2��CH2��CHO��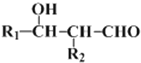
��1��д����Ӧ���ͣ���Ӧ��_______����Ӧ��______��
��2��д���ṹ��ʽ��A______��C_______��
��3���ڷ�Ӧ���У�1mol C7H5O2Br�������NaOH____mol��
��4��д����Ӧ����ʽ����Ӧ��________��
��5��д��һ�ַ�������������E��ͬ���칹��__________
i��1mol��������1mol Na2CO3��Ӧ������1mol CO2����
ii������4�ֻ�ѧ������ͬ����ԭ��
��6��д��ʵ������Y�Ʊ�����ͪ��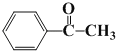 ���ĺϳ�·�ߣ��������IJ���_____________
���ĺϳ�·�ߣ��������IJ���_____________
���ϳ�·�߳��õı�ʾ��ʽΪ��A![]() B����
B����![]() Ŀ����� ��
Ŀ����� ��
���𰸡�ȡ����Ӧ ��ȥ��Ӧ ![]()
 3
3 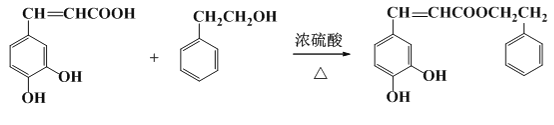 +H2O
+H2O  ��
��
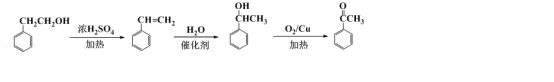
��������
����A�����б�����һ�����ֻ��2�ֽ��A�ķ���ʽΪC7H6O2����AΪ![]() ��A������Ӧ������C7H5O2Br���������ϵ�һ���ⱻ��ȡ����C7H5O2Br����������ˮ��Һ�з���ˮ�ⷴӦ����B��B�ữ����
��A������Ӧ������C7H5O2Br���������ϵ�һ���ⱻ��ȡ����C7H5O2Br����������ˮ��Һ�з���ˮ�ⷴӦ����B��B�ữ���� ������C7H5O2Br�Ľṹ��ʽΪ
������C7H5O2Br�Ľṹ��ʽΪ ��
�� ��X��Ӧ����C��C��ˮ����D��D����������Ӧ����E��E��Y��Ӧ����
��X��Ӧ����C��C��ˮ����D��D����������Ӧ����E��E��Y��Ӧ���� ���������Ʒ������ѵó�EΪ
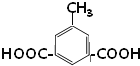
���������Ʒ������ѵó�EΪ ��YΪ
��YΪ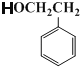 ������D����������Ӧ����E����DΪ
������D����������Ӧ����E����DΪ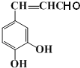 ������C��ˮ����D����CΪ
������C��ˮ����D����CΪ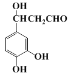 ����
����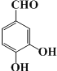 ��X��Ӧ����C�������Ϣii��Ӧ����XΪCH3CHO���ݴ˷������
��X��Ӧ����C�������Ϣii��Ӧ����XΪCH3CHO���ݴ˷������
(1)��Ӧ���DZ����ϵ�һ���ⱻ��ȡ��������Ϊȡ����Ӧ����Ӧ��ΪC��ˮ������ȥ��Ӧ����D������Ϊ��ȥ��Ӧ��
(2)�������Ϸ�����A�ṹ��ʽ ��C�ṹ��ʽΪ
��C�ṹ��ʽΪ ��
��
(3)�ڷ�Ӧ���У�1mol C7H5O2Br��������ṹ��ʽΪ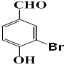 ��±������ԭ������NaOH2mol�����ǻ�����NaOH1mol������1mol C7H5O2Br�������NaOH3mol��
��±������ԭ������NaOH2mol�����ǻ�����NaOH1mol������1mol C7H5O2Br�������NaOH3mol��
(4)��Ӧ��ΪE��Y����������Ӧ������ʽΪ�� ��
��
(5)EΪ i�� 1mol��������1mol Na2CO3��Ӧ������1mol CO2���壬˵������2���Ȼ���ii������4�ֻ�ѧ������ͬ����ԭ�ӣ���һ��Գƽṹ�����Է���������E��ͬ���칹��Ϊ
i�� 1mol��������1mol Na2CO3��Ӧ������1mol CO2���壬˵������2���Ȼ���ii������4�ֻ�ѧ������ͬ����ԭ�ӣ���һ��Գƽṹ�����Է���������E��ͬ���칹��Ϊ ��
��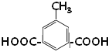 ��
��
(6)��Y�� �Ʊ�����ͪ(
�Ʊ�����ͪ(![]() )����������Ʒ���Ҫ�ϳ�
)����������Ʒ���Ҫ�ϳ�![]() ����Ҫ�õ�
����Ҫ�õ�![]() ��Ҫ�õ�
��Ҫ�õ�![]() ����Ҫ�ϳ�
����Ҫ�ϳ�![]() ��
��![]() ��Ũ������������·�����ȥ��Ӧ���ɵõ�
��Ũ������������·�����ȥ��Ӧ���ɵõ�![]() ����������Ϊ��
������������ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Ʊ����跴Ӧ���Ȼ�ѧ����ʽ���£�SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)����H=+QkJ��mol-1(Q��0)��ij�¶ȡ�ѹǿ�£���һ������Ӧ��ͨ���ܱ������������Ϸ�Ӧ������������ȷ���ǣ� ��
Si(s)+4HCl(g)����H=+QkJ��mol-1(Q��0)��ij�¶ȡ�ѹǿ�£���һ������Ӧ��ͨ���ܱ������������Ϸ�Ӧ������������ȷ���ǣ� ��
A.��Ӧ�����У�������ѹǿ�����SiCl4��ת����
B.����Ӧ��ʼʱSiCl4Ϊ1mol�����ƽ��ʱ����������ΪQkJ
C.��Ӧ��4minʱ����HClŨ��Ϊ0.12mol��L-1����H2��Ӧ����Ϊ0.03mol��L-1��min-1
D.����Ӧ��������Ϊ0.025QkJʱ�����ɵ�HClͨ��100mL1mol��L-1��NaOH��Һǡ�÷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش���������
��1��ij�¶�ʱ�����pH��11��Ba(OH)2��ҺŨ����0.005mol��L��1��
�ٸ��¶���ˮ�����ӻ�����Kw��________��
���ڴ��¶��£���pH��12��Ba(OH)2��ҺVa L��pH��2������Vb L��ϡ������û��ҺΪ���ԣ���Va��Vb��________��
��2��25 ��ʱ���������ʵĵ���ƽ�ⳣ�����±���ʾ����ش��������⣺
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1��4.3��10��7 K2��5.6��10��11 | 3.0��10��8 |
������˵����ȷ����__________
A��25 ��ʱ����CH3COOH��Һ�м���������NaOH��Һ��CH3COOH�ĵ���̶�������ƽ�ⳣ������
B��0.1molL-1 CH3COOH��Һ��ˮϡ�ͣ�ϡ�ͺ����Һ��ˮ�ĵ���̶ȼ�С
C��0.1molL-1 HClO��Һ��0.1molL-1 NaClO��Һ�������ϳ���Һ����
D��̼��������Һ������������Ŀ���
�� ͬŨ�ȵ�CH3COO����HCO��CO32-��ClO�����H����������ǿ������˳��Ϊ___
�� 25 ��ʱ��ijCH3COOH��CH3COOK�����Һ�����ԣ���û����Һ�У�![]() =________
=________
��3��úȼ���ŷŵ���������SO2��NO�����ü��Ե�NaClO2��Һ��Ϊ���ռ���ͬʱ���������������������ڹ��ݷ�Ӧ����ͨ�뺬��SO2��NO����������Ӧ�¶�Ϊ323 K��NaClO2��ҺŨ��Ϊ5��103mol��L1����Ӧ10min����Һ������Ũ�ȵķ���������±���
���� | SO42 | SO32 | NO3 | NO2 | Cl |
c/��mol��L1�� | 8.35��104 | 6.87��106 | 1.5��104 | 1.2��105 | 3.4��103 |
��д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ______��
���������Ca(ClO)2���NaClO2��������Ч������á��Դӻ�ѧƽ��ԭ��������Ca(ClO)2���NaClO2���е��ŵ���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cl2ͨ��100mL NaOH��Һ�г�ַ�Ӧ������0.1mol��NaCl������˵����ȷ���ǣ�������
A.��Ӧ����Һ��ClO���ĸ���Ϊ0.1NA
B.ԭNaOHŨ��Ϊ1mol/L
C.�μӷ�Ӧ����������Ϊ0.1NA
D.ת�Ƶ���Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ��������Ʊ������մɵ�ԭ��MgO��MgSO4��s��+CO��g��MgO��s��+CO2��g��+SO2��g����Q���ﵽƽ������·�����ȷ���ǣ�������
A.��������þ���壬ƽ�������ƶ�
B.�ﵽƽ��ʱ�������ƽ�����������ֲ���
C.����������䣬����CO���ﵽƽ��Ĺ������淴Ӧ����������
D.1mol MgSO4��1mol CO��Ӧ���ﵽƽ��ʱ��������ΪQ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�����̼����ض�����Ҫ�Ļ�ѧ�Լ��빤ҵԭ�ϣ����й㷺����;��
��1����̼��ء�ʯ��ʯ�Ͷ���������и������գ��ɵõ����ΪK2OCaO6SiO2�ļز�����ͬʱ�ų�CO2��������5.1kg�ز������ŷŵ�CO2�ڱ�״���µ������_____L��
��2����֪�����������ǿ��̼�ᣮ��ҵ����̼�����̼����صĻ����Һ����SO2����ַ�Ӧ��������Һ������±���
���� | K2CO3 | KHCO3 | K2SO3 |
������kg�� | 55.2 | 120.0 | 63.2 |
����ԭ����Һ��̼�����̼����ص����ʵ���֮��_______________��
��3�������ϱ��е����ݣ������ϱ��Ļ����Һ��������SO2���������������SO2���ܽ⣩��_____________
��4�����ȵ�ŨCuSO4��Һ��K2CO3��Һ��ϣ�����������һ����ɫ��״���壨�����ᾧˮ����ʽ��Ϊ376�����м�Ԫ�ص���������Ϊ0.104��ȡ0.02mol�þ�������������ϡ�����У�û������������ټ���BaCl2������9.32g��ɫ������ͨ�������ƶϾ���Ļ�ѧʽ��___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ�������
A. ��������Һ��ͨ�������Ķ�����̼�������DZ��Ӻ�̼����
B. ����ͬϵ���У������Ͳ����Ӱ�죬ʹ�ö��߾��ױ�����
C. ![]() �ں˴Ź��������г�������壬����ԭ����֮��Ϊ3��2
�ں˴Ź��������г�������壬����ԭ����֮��Ϊ3��2
D. ����ȩ������ϩ�����е�����ԭ�ӿ��ܴ���ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�
�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90��������30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺����ؽᾧ�ò��ᾧ�壬������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%���������������ǣ�_________��
��2��ʵ����������μӹ��죬�����²�������½�����ԭ����_________��
��3����������Ƿ�ˮ����ȫ���õ��Լ�Ϊ_________��
��4�������ؽᾧ�ļ�ѹ���˲����У����ձ����������⣬������ʹ�����ڹ����β��ϵ�������_________��
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��ȡ����Ʒ0.12g��������ˮ��ȫ�ܽ⣬Ȼ����0.020molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ������ʱ��Һ��ɫ�仯Ϊ_________���ζ�ǰ��ζ����е�Һ�������ͼ2��ʾ����ò��ᾧ����Ʒ�ж�ˮ�ϲ������������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͬ�¶���CH3COOH��NH3H2O�ĵ��볣����ȣ�����10mLŨ��Ϊ0.1molL��1��CH3COOH��Һ�еμ���ͬŨ�ȵİ�ˮ���ڵμӹ����У�������
A.ˮ�ĵ���̶�ʼ������
B.c��NH4+����c��NH3H2O��ʼ�ռ�С
C.c��CH3COOH����c��CH3COO��֮��ʼ�ձ��ֲ���
D.�����백ˮ�����Ϊ10mLʱ��c��NH4+��=c��CH3COO����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com