
【题目】某实验室废液含![]() 、Na+、Fe3+、Cr3+、
、Na+、Fe3+、Cr3+、![]() 、
、![]() 等离子,现通过如下流程变废为宝制备K2Cr2O7。
等离子,现通过如下流程变废为宝制备K2Cr2O7。

已知:
(a)![]() ;
;![]()
(b)金属离子形成氢氧化物沉淀的pH范围如表。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
请回答:
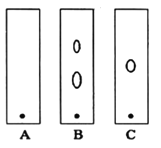
(1)某同学采用纸层析法判断步骤①加入KOH的量是否合适。在加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后的斑点如图所示。加入KOH最适合的实验编号是(实验顺序已打乱)________,C的斑点颜色为________。
(2)步骤②含Cr物质发生的主要反应的离子方程式为________________________。
(3)在下列装置中,②应选用________。(填标号)
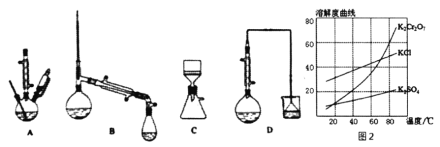
(4)部分物质的溶解度曲线如图2,步骤⑤可能用到下列部分操作:a.蒸发至出现大量晶体,停止加热;b.冷却至室温;c,蒸发至溶液出现晶膜,停止加热;d.洗涤;e.趁热过滤;f.抽滤。请选择合适操作的正确顺序________。
(5)步骤⑤中合适的洗涤剂是________(“无水乙醇”、“乙醇-水混合液”、“热水”、“冰水”)。
(6)取mg粗产品配成250mL溶液,取25.00mL于锥形瓶中,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液滴定(杂质不反应),消耗标准(NH4)2Fe(SO4)2溶液VmL,则该粗产品中K2Cr2O7的纯度为________。
【答案】A 黄色 2Cr(OH)3 +3H2O2+4OH-=2CrO42- +8H2O A aebfd 冰水 ![]() ×100%
×100%
【解析】
某实验室废液含Na+、Fe3+、Cr3+、SO42-、PO43-等离子,加入KOH,可生成Fe(OH)3、Cr(OH)3沉淀,沉淀加入过氧化氢,发生氧化还原反应生成CrO42-,过滤,红褐色沉淀为Fe(OH)3,加入酸可生成K2Cr2O7,由图1可知,蒸发至出现大量晶体,停止加热,趁热过滤除外KCl等,然后冷却至室温、抽滤、洗涤可得到K2Cr2O7,以此解答该题。
(1)加入氢氧化钠最适合时,Fe3+、Cr3+恰好生成沉淀,则A为合适,在加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后发生Cr3++6NH3=[Cr(NH3)6]3+(黄色),则斑点呈黄色,
故答案为:A;黄色;
(2)根据分析可知步骤②含Cr物质被氧化,发生的主要反应的离子方程式为2Cr(OH)3+3H2O2+4OH-=2CrO42-+8H2O,
故答案为:2Cr(OH)3+3H2O2+4OH-=2CrO42-+8H2O;
(3)步骤②反应需要加热,且反应中需要加入液体,因此选用A装置;
故答案为:A;
(4)步骤⑤由溶液得到晶体,实验时,蒸发至出现大量晶体,停止加热,趁热过滤除外KCl等,然后冷却至室温、抽滤、洗涤可得到K2Cr2O7,则顺序为aebfd,
故答案为:aebfd;
(5))K2Cr2O7具有强氧化性,不能用乙醇洗涤,在温度较低时溶解度较小,则用冷水洗涤,故答案为:冰水;
(6)该滴定实验的滴定原理为利用Fe2+使Cr2O72-完全转化为Cr3+,二者数量关系为Cr2O72-~6Fe2+,滴定过程消耗的n(Fe2+)=cV/1000mol,故待测液中K2Cr2O7物质的量为![]() mol,所以样品中K2Cr2O7物质的量为
mol,所以样品中K2Cr2O7物质的量为![]() mol,质量为
mol,质量为![]() g,所以质量分数为:
g,所以质量分数为: ![]() ×100%,
×100%,
故答案为:![]() ×100%
×100%


科目:高中化学 来源: 题型:
【题目】在抗击新冠肺炎的过程中,科研人员研究了法匹拉韦、利巴韦林、氯硝柳胺等药物的疗效,三种药物主要成分的结构简式如下。下列说法不正确的是
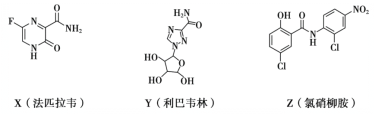
A.X的分子式为C5H4O2N3F
B.Z中含有6种官能团
C.Y和Z都有羟基,但性质不完全相同
D.X和Z都能发生加成反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.1 L0.1mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
C.4.0 g![]() 与D2O的混合物中所含中子数为2NA
与D2O的混合物中所含中子数为2NA
D.50 mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.![]()
![]()
回答下列问题:
(1)已知:Ⅱ.![]()
![]()
Ⅲ.![]()
![]()
则![]() =________(用含
=________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2L的甲乙两个恒温密闭容器中分别加入4mol NH3和4mol Cl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲(T1) | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80min内,容器甲中v(NH3)=________________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于容器乙,下列说法正确的是________(填选项字母)。
A.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
B.反应进行到70min时,v正一定大于v逆
C.容器内气体平均相对分子质量在增大,说明平衡在正向移动
D.达平衡后,加入一定量NCl3(l),平衡逆向移动
E.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④温度为T1时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2L的恒压容器,平衡时容器中n(Cl2)________(填“>”、“=”或“<”)1.6mol。
⑤温度为T2时,该反应的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关实验的描述正确的是( )
A.可用CCl4萃取碘酒中的碘
B.做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物为一定为钾盐
C.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液
D.室温下,浓度为0.1molL-1Na2S2O3和H2SO4溶液,分别取5mL与10mL混合,10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加
B.设NA为阿伏加德罗常数的值,500mL1mol/L氯化铁溶液中Fe3+的数目等于0.5NA
C.常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12
D.要判断反应进行方向,须综合考虑体系的焓变和熵变,焓减且熵增的反应为自发反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个固定体积的密闭容器充入 2mol A 和 1mol B,发生如下反应:2A(g)+B(g) 3C(g)+D(g),2 分钟后,反应达到平衡,C 的浓度为 1.2mol/L。
(1)用 A 表示 2 分钟内平均反应速率为_____,A 在第 1 分钟平均速率_______第 2分钟平均速率(填“<”、“>”、“=”)。
(2)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为_____(填“吸热”或“放热”)反应.
(3)增大 B 的转化率,可采取的措施是_____(用序号填空)
①加入 A ②加入 B ③加压④再加入 1.6mol A+0.8mol B ⑤将 C 分离出容器
(4)若在相同条件下,在上述容器中充入 1.5mol C 和 0.5mol D 发生上述反应,为使平衡后,C 的浓度仍为 1.2mol/L,则应再充入_____molA 和_____molB.
(5)若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a 点改变的条件可能是_____;b 点改变的条件可能是_____;若升高温度时,请将反应速率变化情况画在 c-d 处。_____________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
(1)该融雪剂的化学式______________;X与氢元素形成的化合物的电子式_____________。
(2)元素D、E原子的最外层电子数均为电子层数的2倍,D与Y相邻,则D离子的原子结构示意图是____________ ;D与E能形成一种非极性分子,该分子的结构式____________;写出与其互为等电子体的一种分子和阴离子________________、___________________。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是____________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,写出该反应的化学方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com