
【题目】现有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)。已知:实验室可用下列反应制取氧气2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
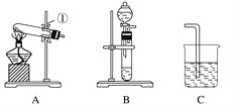
(1)写出仪器名称:①________,②________。
(2)实验室制取并收集氧气时,应选择____________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验时,应选择________和________相连接,检验生成气体时使用的试剂是________,检验气体时观察到的实验现象是_________________。
(4)制取氢气并做还原氧化铜的实验时,应选择______和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_______________________________。
【答案】铁架台 酒精灯 A E A C 澄清石灰水 C中溶液变浑浊 B D 防止生成的铜再和氧气反应
【解析】
(1)根据仪器的图形、构造判断仪器的名称;
(2)实验室可用加热氯酸钾固体制备氧气,根据氧气密度大于空气分析;
(3)做木炭还原氧化铜并检验生成气体的实验,可在大试管中加热条件下进行,用澄清石灰水检验;
(4)用稀硫酸和锌反应制备氢气,在大试管中加热条件下进行还原实验,实验结束时应先停止加热,待试管冷却后,再停止通氢气,防止铜被氧化。
(1)由仪器的图形、构造判断①为铁架台,②为酒精灯;
(2)实验室可用加热氯酸钾固体制备氧气,氧气密度比空气大,可用向上排空法收集,则选用A、E装置;
(3)做木炭还原氧化铜并检验生成气体的实验,可在大试管中加热条件下进行,氧化产物是二氧化碳,因此可用澄清石灰水检验,所以用A、C装置,检验气体时观察到的实验现象是C中澄清石灰水变浑浊;
(4)用稀硫酸和锌反应制备氢气,在大试管中加热条件下进行还原实验,可用B、D装置,在加热的条件下铜易被氧化,所以实验结束时应先停止加热,待试管冷却后,再停止通氢气,防止生成的铜再和氧气反应。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 高级脂肪酸乙酯的碱性水解属于皂化反应
B. 蔗糖、淀粉、纤维素均为高分子化合物
C. 硫酸铜溶液可使蛋白质变性,可用于游泳池的杀菌消毒
D. 氨基酸分子中都含有-NO2 和-COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH===CH2+HBr―→CH3—CHBr—CH3(主要产物),1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下图所示的一系列变化。

(1)A的化学式:___________________,
(2)A的结构简式:_________________________。
(3)写出C、D、E、H物质的结构简式:
C____________________,D________________,E________________,H_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如下:
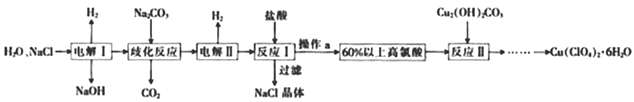
(1)发生“电解I”时,所用的交换膜是_______________(填“阳离子交换膜”或“阴离子交换膜”)。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。
①“歧化反应”的化学方程式为____________________________。
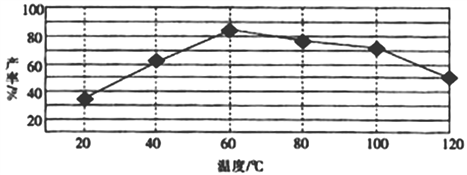
②“歧化反应”阶段所采用的不同温度对产率影响的结果如图所示。则该反应最适宜的温度是___。
(3)“电解II”的阳极产物为______________(填离子符号)。
(4)操作a的操作名称是_______,该流程中可循环利用的物质是_____________(填化学式)。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为at,最终制得的Cu(ClO4)2·6H2O为bt,则产率为__________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是

A. XOH为强碱,MOH、YOH均为弱碱
B. V[HCl(aq)]=15.00mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH
C. V[HCl(aq)]=20.00mL时,三种溶液中水的电离程度:XOH>MOH>YOH
D. V[HCl(aq)]=40.00ml.时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是常温下,浓度为0.01mol/L的NaOH溶液与几种酸或盐混合后的情况:
混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
① | c(HA)=0.02mol/L | 等体积混合,pH>7 |
② | HB溶液的pH=2 | V1mLNaOH溶液与V2mLHB溶液,pH=7 |
③ | c(H2C)=0.01mol/L | 等体积混合,pH>7 |
④ | c(NaHD)=0.01mol/L | 等体积混合,pH=7 |
回答下列问题:
(1)①组混合液中,HA、A-、Na+三种粒子浓度由大到小的顺序为________,若pH=8,则c(Na+)-c(A-)=________mol/L(填具体数字)。
(2)由②组混合液pH=7可推知,V1____V2。
(3)③组混合液中,pH>7的原因是______________________。
(4)0.01mol/LNaHD溶液中,水的电离度=_________。(已知:水的电离度=[已电离的水分子的个数/水分子总数]×100%)
(5)仅凭上述结果,一定能确定HA、HB、H2C、H2D四种酸中属于弱酸的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学探究小组设计实验探究某种氮的化合物的制备及性质。
【探究一】下图A为某气体制备装置,图中未画出。

据此回答:
(1)①只用一种试剂制备A中某气体,选取的试剂是____________。
a.NH4HCO3 b.NH4Cl c.Ca(OH)2 d.NH4NO3
②装置A所用的主要玻璃仪器是____________(填仪器名称)。
(2)从装置A进入装置B的物质在B中被充分吸收,写出B中发生反应的化学方程式_______________________________(写出一个即可)。
【探究二】为探究上述装置中产生的气体性质,该化学探究小组又组装了如下装置,其中C处硬质试管中装有红色粉末铜粉。

用酒精灯加热C处硬质试管一段时间后,再通入上述实验产生的气体,过一会撤去C处酒精灯。
据此回答:
(3)若实验过程中发现F处铜片逐渐溶解。则:
①D中观察到的现象是________________________________。
②C中发生反应的化学方程式为________________________________。
③F处铜片逐渐溶解的原因是________________________________。
④该装置的不足之处是________________________________。
(4)若实验过程中F处铜片没有任何变化,D中无任何现象发生,只观察到C中粉末在红色和黑色间交替变化。则C中发生反应的化学方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com