
| A. | 4mol | B. | 3mol | C. | 5mol | D. | 2.5mol |
分析 乙烯含碳碳双键,与氯气以1:1反应,烷烃中H被Cl取代,取代的氢原子的物质的量与氯气的物质的量相等,以此来解答.
解答 解:由C2H4+Cl2→CH2ClCH2Cl,则1mol乙烯与氯气发生加成反应需要Cl21mol;
CH2ClCH2Cl+4Cl2$\stackrel{光照}{→}$CCl3CCl3+5HCl,所以1molCH2ClCH2Cl与氯气发生取代反应,最多可再消耗Cl2的物质的量为4mol,
故选A.
点评 本题考查化学反应的计算,为高频考点,把握有机物的性质、发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意该题为计算取代反应需要的氯气,题目难度不大.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 23g/L | B. | 27.2g/L | C. | 29.25g/L | D. | 32.4g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ② | C. | ②③ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在 2,2-二甲基-3-戊炔 | |
| B. | 月桂烯分子中( 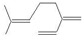 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | CF2Cl2存在两种同分异构体 | |
| D. | 用红外光谱法可鉴别二甲醚和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
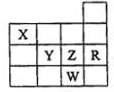
| A. | 常压下五种元素的单质中W单质的沸点最高 | |
| B. | Y、Z和W的阴离子半径依次增大 | |
| C. | X的氢化物比同族元素的氢化物还原性强 | |
| D. | Z元素的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 酸 | HM | HN | HR |
| 电离常数 K | 9×10-7 | 9×10-6 | 10-2 |
| A. | 三种酸的强弱关系:HM>HN>HR | |
| B. | 反应 HR+N-═HN+R-能够发生 | |
| C. | 相同温度下,0.1 mol/L 的 HM、HN、HR 溶液,HM 溶液 pH 最大 | |
| D. | 相同温度下,1 mol/L HM 溶液的电离常数大于 0.1 mol/L HM |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周 期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i | |
| 4 | j | k |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com