
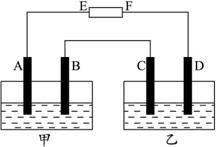
Ķ¼1-9
(1)µē³ŲÖŠEŹĒ______________¼«£¬FŹĒ______________¼«”£
(2)A¼«ÉĻµē¼«·“Ó¦ĪŖ______________£¬B¼«ÉĻµē¼«·“Ó¦ĪŖ______________£¬C¼«ÉĻµē¼«·“Ó¦ĪŖ______________£¬D¼«ÉĻµē¼«·“Ó¦ĪŖ______________”£
(3)µ±µēĀ·ÖŠĶعż2.408”Į1022øöµē×ÓŹ±Ķ£Ö¹µē½ā£¬·¢ĻÖB¼«ÉĻĪö³ö1.27 g M,Ōņ½šŹōMµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ______________”£
(4)Čē¹ūŌŁ½«Ķā½ÓÖ±Į÷µēŌ“µÄÕżøŗ¼«½»»»½ÓČėŌµēĀ·£¬µ±Ķعż1 molµē×Óŗó£¬B¼«µÄµē¼«·“Ó¦ĪŖ______________”£
½āĪö£ŗÓɼ××°ÖĆBÉĻÓŠ½šŹōMĪö³ö£¬æɵĆB¶ĖĪŖŅõ¼«£¬½ų¶ųµĆµēŌ“EĪŖÕż¼«£¬FĪŖøŗ¼«£¬ÕāѳȯŅ×µĆA”¢B”¢C”¢D·Ö±šĪŖŃō¼«”¢Ņõ¼«”¢Ńō¼«”¢Ņõ¼«£¬µē¼«·“Ó¦ŗÜČŻŅ׊“(¼ū“š°ø)ÓŠB¼«µē¼«·“Ó¦M2++2e-![]() M£¬µĆMµÄĪļÖŹµÄĮæĪŖ
M£¬µĆMµÄĪļÖŹµÄĮæĪŖ![]() =0.02 mol½ų¶ųMµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ
=0.02 mol½ų¶ųMµÄĻą¶ŌŌ×ÓÖŹĮæĪŖ![]() =63.5
=63.5
Čō½«µēŌ“Õżøŗ¼«»„»»£¬B¶ĖŌņĪŖŃō¼«£¬µē¼«·“Ó¦ĪŖ4OH-![]() 2H2O+O2”ü+4e-
2H2O+O2ӟ+4e-
“š°ø£ŗ(1)Õż øŗ
(2)M![]() M2++2e- M2++2e-
M2++2e- M2++2e-![]() M 4OH-
M 4OH-![]() 2H2O+ O2ӟ+4e-
2H2O+ O2ӟ+4e-
4H++4e-![]() 2H2ӟ
2H2ӟ
(3)63.5
(4)4OH-![]() 2H2O+O2ӟ+4e-
2H2O+O2ӟ+4e-



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
 Ģ¼ŗĶĢ¼µÄ»ÆŗĻĪļŌŚÉś²ś”¢Éś»īÖŠµÄÓ¦ÓĆ·Ē³£¹ć·ŗ£¬ŌŚĢį³«½”æµÉś»īŅŃ³É³±Į÷µÄ½ńĢģ£¬”°µĶĢ¼Éś»ī”±²»ŌŁÖ»ŹĒŅ»ÖÖĄķĻė£¬øüŹĒŅ»ÖÖÖµµĆĘŚ“żµÄŠĀµÄÉś»ī·½Ź½£®
Ģ¼ŗĶĢ¼µÄ»ÆŗĻĪļŌŚÉś²ś”¢Éś»īÖŠµÄÓ¦ÓĆ·Ē³£¹ć·ŗ£¬ŌŚĢį³«½”æµÉś»īŅŃ³É³±Į÷µÄ½ńĢģ£¬”°µĶĢ¼Éś»ī”±²»ŌŁÖ»ŹĒŅ»ÖÖĄķĻė£¬øüŹĒŅ»ÖÖÖµµĆĘŚ“żµÄŠĀµÄÉś»ī·½Ź½£®| øßĪĀ |
| ŹµŃé×é | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

ŹŌøł¾ŻĶʶĻ»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)Š“³öA”¢B·“Ӧɜ³ÉCµÄĄė×Ó·½³ĢŹ½£ŗ__________________________________”£
(2)Š“³öÓÉHÉś³ÉIµÄ»Æѧ·½³ĢŹ½£ŗ__________________________________”£
(3)A”¢C”¢E”¢GŃõ»ÆŠŌÓÉĒæµ½ČõµÄĖ³ŠņĪŖ”£(ÓĆĻąÓ¦ĪļÖŹµÄ»ÆѧŹ½±ķŹ¾)
(4)EµÄČÜŅŗæÉŅŌ×÷¾»Ė®¼Į£¬ÓĆĄė×Ó·½³ĢŹ½ŗĶ±ŲŅŖµÄĪÄ×Ö½āŹĶĘä¾»Ė®ŌĄķ£ŗ_____________”£
(5)KĪļÖŹæÉÄÜĪŖ(ÖĮÉŁŠ“Į½ÖÖ)__________________________________”£
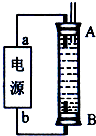
(6)ijĶ¬Ń§Éč¼ĘĮĖŅ»ÖÖµē½ā·ØÖĘČ”HµÄŹµŃé×°ÖĆ(ČēĻĀĶ¼ĖłŹ¾)”£Ķصēŗó£¬ČÜŅŗÖŠ²śÉś“óĮæµÄH£¬ĒŅ½Ļ³¤Ź±¼ä²»±»Ńõ»Æ”£

ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ___________________________________________________”£
A.Ņõ”¢ŃōĮ½¼«µÄ²ÄĮĻ±ŲŠėĻąĶ¬
B.æÉŅŌÓĆNaOHČÜŅŗ×÷ĪŖµē½āŅŗ
C.æÉŅŌÓĆNaClČÜŅŗ×÷ĪŖµē½āŅŗ
D.aŅ»¶ØĪŖÕż¼«£¬bŅ»¶ØĪŖøŗ¼«
E.Ņõ¼«·¢ÉśµÄ·“Ó¦ŹĒ£ŗ2H++2e-![]() H2”ü
H2ӟ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
£Ø15·Ö£©¼×“¼£ØCH3OH£©ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬¹ć·ŗÓ¦ÓĆÓŚ»Æ¹¤Éś²ś£¬Ņ²æÉŅŌÖ±½ÓÓĆ×öČ¼ĮĻ”£ŅŃÖŖ
CH3OH(1)+ O2(g) = CO(g) + 2H2O(g) £» ”÷Ha= £443.64 kJ”¤mol£1
2CO(g) + O2(g) = 2CO2(g) £» ”÷H b =£566.0 kJ”¤mol£1
£Ø1£©ŹŌŠ“³öCH3OH(1)ŌŚŃõĘųÖŠĶźČ«Č¼ÉÕÉś³ÉCO2ŗĶH2O£Øg£©µÄČČ»Æѧ·½³ĢŹ½£ŗ
£Ø2£©¼×“¼×÷ĪŖČ¼ĮĻ£¬ĖüµÄÓŵćŹĒČ¼ÉÕŹ±ÅŷŵÄĪŪČ¾ĪļÉŁ£¬“Ó¶ų²»½öÄÜ»ŗ½āÄÜŌ“½ōÕÅŗĶĪĀŹŅŠ§Ó¦µÄĪŹĢā£¬»¹ÄÜøÄÉĘ“óĘųÖŹĮ攣ŹŌĄūÓĆ£Ø1£©ÖŠµÄČČ»Æѧ·½³ĢŹ½¼ĘĖć£¬ĶźČ«Č¼ÉÕ20g¼×“¼£¬Éś³É¶žŃõ»ÆĢ¼ŗĶĖ®ÕōĘūŹ±£¬·Å³öµÄČČĮæĪŖ kJ £¬Éś³ÉµÄCO2ĘųĢå±ź×¼×“æöĻĀĢå»żŹĒ L
£Ø3£©æĘŃŠČĖŌ±ŠĀ½üæŖ·¢³öŅ»ÖÖÓɼד¼ŗĶŃõĘųŅŌĒæ¼ī×öµē½āÖŹČÜŅŗµÄŠĀŠĶŹÖ»śµē³Ų£¬æÉŹ¹ŹÖ»śĮ¬ŠųŹ¹ÓĆŅ»øöŌĀ²Å³äŅ»“Īµē£¬¾Ż“Ė»Ų“šĻĀĮŠĪŹĢā£ŗ
¼×“¼ŌŚ ¼«·“Ó¦£»µē¼«·“Ó¦Ź½ĪŖ ”£
£Ø4£©ĄūÓƵē³ŲæÉŹµĻÖµēÄÜĻņ»ÆѧÄÜ×Ŗ»Æ”£Ä³Ķ¬Ń§Éč¼ĘĮĖŅ»ÖÖµē½ā·ØÖĘČ”Fe(OH)2µÄŹµŃé×°ÖĆ£ØČēĻĀĶ¼ĖłŹ¾£©£¬Ķصēŗó£¬ČÜŅŗÖŠ²śÉś“óĮæµÄ°×É«³Įµķ£¬ĒŅ½Ļ³¤Ź±¼ä²»±äÉ«”£ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ £ØĢīŠņŗÅ£©
A£®µēŌ“ÖŠµÄaŅ»¶ØĪŖÕż¼«£¬bŅ»¶ØĪŖøŗ¼«
B£®æÉŅŌÓĆNaClČÜŅŗ×÷ĪŖµē½āŅŗ
C£®A”¢BĮ½¶Ė¶¼±ŲŠėÓĆĢś×÷µē¼«
D£®Ņõ¼«·¢ÉśµÄ·“Ó¦ŹĒ£ŗ2H+ + 2e£”śH2”ü
Čō½«ĖłµĆFe(OH)2³Įµķ±©Ā¶ŌŚæÕĘųÖŠ£¬ĘäŃÕÉ«±ä»ÆŹĒ £¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015½ģŗž±±Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø9·Ö£©Ä³ÖÖĢ¼ĖįĆĢæóµÄÖ÷ŅŖ³É·ÖÓŠMnCO3”¢MnO2”¢FeCO3”¢MgO”¢SiO2”¢Al2O3µČ”£ŅŃÖŖĢ¼ĖįĆĢÄŃČÜÓŚĖ®”£Ņ»ÖÖŌĖÓĆŅõĄė×ÓĤµē½ā·ØµÄŠĀ¼¼ŹõæÉÓĆÓŚ“ÓĢ¼ĖįĆĢæóÖŠĢįČ”½šŹōĆĢ£¬Į÷³ĢČēĻĀ£ŗ

ŅõĄė×ÓĤ·Øµē½ā×°ÖĆČēĻĀĶ¼ĖłŹ¾£ŗ

£Ø1£©Š“³öÓĆĻ”ĮņĖįČܽāĢ¼ĖįĆĢ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ ”£
£Ø2£©ŅŃÖŖKsp
(Fe(OH)3) = 4 ´10ØC38£¬¼ŁÉčČÜŅŗÖŠFe3+Ąė×ÓÅضČĪŖ0£®1 mol”¤LØC1£¬ŌņæŖŹ¼Éś³ÉFe(OH)3
³ĮµķµÄpHŹĒ_________£¬³ĮµķĶźČ«µÄpHŹĒ_________”££ØæÉÄÜÓƵ½µÄŹż¾Ż£ŗlg =
-0£®1 lg
=
-0£®1 lg =0£®2£©
=0£®2£©
£Ø3£©ŅŃÖŖ²»Ķ¬½šŹōĄė×ÓÉś³ÉĒāŃõ»ÆĪļ³ĮµķĖłŠčµÄpHČēĻĀ±ķ£ŗ
|
Ąė×Ó |
Fe3+ |
A13+ |
Fe2+ |
Mn2+ |
Mg2+ |
|
æŖŹ¼³ĮµķµÄpH |
1£®2 |
3£®7 |
7£®0 |
7£®8 |
9£®3 |
|
³ĮµķĶźČ«µÄpH |
3£®7 |
4£®7 |
9£®6 |
9£®8 |
10£®8 |
¼Ó°±Ė®µ÷½ŚČÜŅŗµÄpHµČÓŚ6£¬Ōņ”°ĀĖŌü£Ø“ż“¦Ąķ£©”±µÄ³É·ÖŹĒ £ØŠ“»ÆѧŹ½£©£¬ĀĖŅŗÖŠŗ¬ÓŠµÄŃōĄė×ÓÓŠH+ŗĶ £ØŠ“·ūŗÅ£©”£
£Ø4£©ŌŚ½ž³öŅŗĄļĆĢŌŖĖŲÖ»ŅŌMn2+µÄŠĪŹ½“ęŌŚ£¬ĒŅĀĖŌüAÖŠŅ²ĪŽMnO2£¬ĒėÓĆĄė×Ó·½³ĢŹ½½āŹĶŌŅņ£ŗ ”£
£Ø5£©µē½ā×°ÖĆÖŠ¼żĶ·±ķŹ¾ČÜŅŗÖŠŅõĄė×ÓŅĘ¶ÆµÄ·½Ļņ£¬ŌņAµē¼«ŹĒÖ±Į÷µēŌ“µÄ ¼«”£Źµ¼ŹÉś²śÖŠ£¬Ńō¼«ŅŌĻ”ĮņĖįĪŖµē½āŅŗ£¬Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ ”£
£Ø6£©øĆ¹¤ŅÕÖ®ĖłŅŌ²ÉÓĆŅõĄė×Ó½»»»Ä¤£¬ŹĒĪŖĮĖ·ĄÖ¹Mn2+½ųČėŃō¼«Ēų·¢Éśø±·“Ӧɜ³ÉMnO2Ōģ³É׏Ō“ĄĖ·Ń£¬Š“³öøĆø±·“Ó¦µÄµē¼«·“Ó¦Ź½£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
ĒāĘųŹĒĒå½ąµÄÄÜŌ“£¬Ņ²ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ”£
£Ø1£©ŅŌH2ĪŖŌĮĻÖĘČ”°±Ęų½ų¶ųŗĻ³ÉCO(NH2)2µÄ·“Ó¦ČēĻĀ£ŗ
N2(g)£«3H2(g)£½2NH3(g) ”÷H£½ØD92.40 kJ”¤mol£1
2NH3(g)£«CO2(g)£½NH2CO2NH4(s) ”÷H£½ØD159.47 kJ”¤mol£1
NH2CO2NH4(s)£½CO(NH2)2(s)£«H2O(l) ”÷H£½£«72.49 kJ”¤mol£1
ŌņN2(g)”¢H2(g)ÓėCO2(g)·“Ӧɜ³ÉCO(NH2)2(s)ŗĶH2O(l)µÄČČ»Æѧ·½³ĢŹ½ĪŖ ”ų ”£
£Ø2£©ÓƱūĶéŗĶĖ®ĪŖŌĮĻŌŚµē“ß»ÆĻĀÖĘĒāĘų£¬Ķ¬Ź±µĆµ½Ņ»ÖÖŗ¬ÓŠČżŌŖ»·µÄ»·Ńõ»ÆŗĻĪļA£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”ų ”£
øĆ·“Ó¦Ņ²æÉÉś³ÉAµÄĶ¬·ÖŅģ¹¹Ģå”Ŗ”ŖĮķŅ»ÖÖ»·Ńõ»ÆŗĻĪļB£¬BµÄŗĖ“Ź²ÕńĒāĘ×ĪŖ
ĻĀĶ¼ÖŠµÄ ”ų £ØĢī”°a”±»ņ”°b”±£©”£
£Ø3£©ŅŃÖŖµžµŖĖį£ØHN3£©²»ĪČ¶Ø£¬Ķ¬Ź±Ņ²ÄÜÓė»īĘĆ½šŹō·“Ó¦£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ
2HN3£½3N2”ü£«H2”ü
2HN3£«Zn£½Zn(N3)2£«H2”ü
2 mol HN3ÓėŅ»¶ØĮæZnĶźČ«·“Ó¦£¬ŌŚ±ź×¼×“æöĻĀÉś³É67.2 LĘųĢ壬ĘäÖŠN2µÄĪļÖŹµÄĮæĪŖ ”ų ”£
£Ø4£©ŅŃÖŖH2SøßĪĀČČ·Ö½āÖĘH2µÄ·“Ó¦ĪŖ£ŗ
H2S(g)![]() H2(g)£«1/2S2(g)
H2(g)£«1/2S2(g)
ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠ£¬æŲÖĘ²»Ķ¬ĪĀ¶Č½ųŠŠH2SµÄ·Ö½āŹµŃé£ŗ
ŅŌH2SµÄĘšŹ¼ÅØ¶Č¾łĪŖc mol”¤L£1²ā¶ØH2SµÄ×Ŗ»ÆĀŹ£¬½į¹ūČēÓŅĻĀĶ¼ĖłŹ¾”£Ķ¼ÖŠ
 aĪŖH2SµÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č¹ŲĻµ
aĪŖH2SµÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č¹ŲĻµ
ĒśĻߣ¬bĒśĻß±ķŹ¾²»Ķ¬ĪĀ¶ČĻĀ·“Ó¦
¾¹żĻąĶ¬Ź±¼äĒŅĪ““ļµ½»ÆŃ§Ę½ŗāŹ±
H2SµÄ×Ŗ»ÆĀŹ”£
Čō985”ꏱ£¬·“Ó¦¾t min“ļµ½Ę½ŗā£¬
“ĖŹ±H2SµÄ×Ŗ»ÆĀŹĪŖ40%£¬Ōņ·“Ó¦
ĖŁĀŹv(H2)£½ ”ų £ØÓĆŗ¬c”¢tµÄ“ś
ŹżŹ½±ķŹ¾£©”£
ĒėĖµĆ÷ĖęĪĀ¶ČµÄÉżøߣ¬ĒśĻßbĻņĒśĻßa±Ę½üµÄŌŅņ£ŗ ”ų ”£
 £Ø5£©ÓƶčŠŌµē¼«µē½āĆŗ½¬ŅŗµÄ·½·ØÖĘH2µÄ·“Ó¦ĪŖ£ŗ
£Ø5£©ÓƶčŠŌµē¼«µē½āĆŗ½¬ŅŗµÄ·½·ØÖĘH2µÄ·“Ó¦ĪŖ£ŗ
C(s)£«2H2O(l)£½CO2(g)£«2H2(g)
ĻÖ½«Ņ»¶ØĮæµÄ1 mol”¤L£1 H2SO4ČÜŅŗŗĶŹŹĮæĆŗ
·Ū³ä·Ö»ģŗĻ£¬ÖĘ³Éŗ¬Ģ¼ĮæĪŖ0.02 g”¤mL£1”«0.12
g”¤mL£1µÄĆŗ½¬Ņŗ£¬ÖĆÓŚÓŅĶ¼ĖłŹ¾×°ÖĆÖŠ½ųŠŠµē
½ā£ØĮ½µē¼«¾łĪŖ¶čŠŌµē¼«£©”£ŌņA¼«µÄµē¼«
·“Ó¦Ź½ĪŖ ”ų ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com