



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| �ɷ� | ������g�� | Ħ��������g ��mol��1�� |
| ���� | 25.0 | 342 |
| ����� | 0.3 | 174 |
| ��˾ƥ�� | 0.2 | 180 |
| ������� | 0.3 | 158 |
| ������ | 0.1 | 170 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���ۢܢ� | C���ڢܢ� | D���ڢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��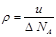 | B��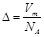 | C��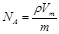 | D��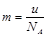 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ʵ���� | �Ͻ�������mg�� | ���������mL�� |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
| �����Ũ�� | NaOH(aq)����� | ||
| A�� | B�� | C�� | D�� |
| 4.0 mol/L | 1.0 mol/L | 75 mL | 99 mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��l��0 L 1��0 moI/L NaA1O2ˮ��Һ�к��е���ԭ����Ϊ2NA |
| B��12 gʯīϩ������ʯī���к�����Ԫ���ĸ���Ϊ0��5 NA |
| C��25��ʱpH =13��NaOH��Һ�к���OH������ĿΪ0��1 NA |
| D��l mol���ǻ���l mol������������������������Ϊ9 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��6.4g | B��3.2g | C��1.6g | D��0.8g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��4��1275g | B��4��255 g | C��8��51 g | D��9��62 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����⾫����ͭʱ��ÿת��NA�����ӣ������ܽ�32gͭ |
| B��1L0��1mo1��L��1�İ�ˮ�к�OH��������Ϊ0��lNA�� |
| C�����³�ѹ�£�a mo1O2��2a mo1NO��ϣ����µõ������������ԭ����С��4aNA |
D���ڷ�Ӧ5NH4NO3 2HNO3+4N2��+9H2O�У�ÿ����4molN2��ת�Ƶ�����Ϊ15NA 2HNO3+4N2��+9H2O�У�ÿ����4molN2��ת�Ƶ�����Ϊ15NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com