
| A. | 铝及其合金是生活中广泛使用的材料,通常用电解氯化铝的方法制取 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 偏二甲肼[NH2N(CH3)2]是一种液体燃料,它的一种同分异构体可以是氨基酸 | |
| D. | 邻苯二甲酸二辛酯常用作增塑剂,对人体无害,可用作食品添加剂 |
分析 A.氯化铝不导电;
B.采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可减少污染物,净化空气;
C.分子式相同结构不同的有机物互为同分异构体;
D.塑化剂对人体健康能造成很大的危害,不能用作食品添加剂.
解答 解:A.工业上用电解熔融氧化铝的方法制取铝,故A错误;
B.采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可减少污染物,净化空气,可提高空气质量,故B正确;
C.氨基酸含有氧元素,偏二甲肼[NH2N(CH3)2]不含氧,所以二者不能形成同分异构体,故C错误;
D.塑化剂不能用作食品添加剂,故D错误;
故选:B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意同分异构体概念,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 反应能量变化 | 放出29.4KJ | 吸收aKJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 25℃,两片相同的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | 将无水乙醇和浓H2SO4的混合物加热至170℃,产生的气体通入酸性KMnO4溶液 | KMnO4溶液紫红色褪去 | 乙烯具有还原性 |
| C | SO2通入BaCl2溶液,然后滴入稀硝酸 | 有白色沉淀产生,加入稀硝酸后沉淀不溶解 | 所得沉淀为BaSO3,后转化为BaSO4 |
| D | 向盛有AgCl固体试管中加入一定量的0.01mol•L-1 KI溶液 | 固体由白色逐渐变为黄色 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的NH4HSO4溶液:Ba2+、Na+、NO3-、Cl- | |
| B. | 通KSCN溶液变红色的溶液:NH4+、Al3+、SO42-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
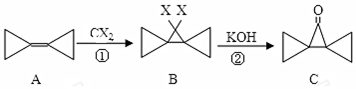
| A. | 反应①是加成反应 | B. | A的所有原子都在一个平面内 | ||
| C. | 反应②是消去反应 | D. | A的二氯代物只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
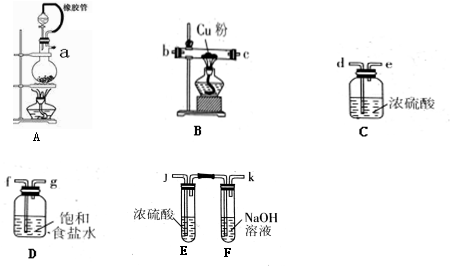
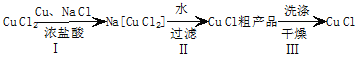
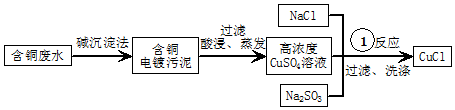
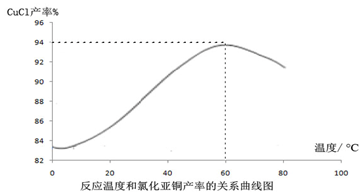
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51 | B. | 54 | C. | 57 | D. | 60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
将铜丝压扁,掰成图案 | 将铅丹、硼酸盐等化合熔制后描绘 | 高温焙烧 | 酸洗去污 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com