
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
分析 A、B、C、D、E短周期五种元素.A是其单质是密度最小的物质,则A为H元素;B的阴离子带两个单位的负电荷,单质是空气主要成分之一,则B为O元素;B为O元素,B的阴离子为O2-,C的阳离子与B的阴离子具有相同的电子层结构,则C原子有3个电子层,且与B可以形成两种离子化合物,则C为Na元素;D的氢氧化物和氧化物都有两性,且与C同周期,则D为Al元素;E与C同周期,其原子半径在该周期最小,则E为Cl元素,以此解答该题.
解答 解:A、B、C、D、E短周期五种元素.A是其单质是密度最小的物质,则A为H元素;B的阴离子带两个单位的负电荷,单质是空气主要成分之一,则B为O元素;B为O元素,B的阴离子为O2-,C的阳离子与B的阴离子具有相同的电子层结构,则C原子有3个电子层,且与B可以形成两种离子化合物,则C为Na元素;D的氢氧化物和氧化物都有两性,且与C同周期,则D为Al元素;E与C同周期,其原子半径在该周期最小,则E为Cl元素,
(1)由分析可知,B为氧元素;E为氯元素,
故答案为:氧;氯;
(2)AlCl3 在熔融状态下不导电,则AlCl3 属于共价化合物,含有共价键,故答案为:共价键;
(3)E为Cl,C为Na,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题以元素推断为载体,为高频考点,侧重学生的分析能力的考查,题目涉及元素化合物性质、原子结构位置与周期律关系、化学用语等,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 预防H7N9流感病毒的措施之一是高温消毒餐具等生活日用品 | |
| B. | 大气中直径小于或等于2.5微米的颗粒物(PM2.5)会造成空气污染,应加强监测和治理 | |
| C. | 我国京津冀等城市实施SO2、CO2、NO2、N2等大气污染物排放限制 | |
| D. | 积极推广太阳能、风能、地热能等新能源的使用,减少化石燃料的使用,有效降低PM2.5对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和硅都是ⅣA的元素,CO2和SiO2属于同种类型的晶体 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | H2O、H2S、H2Se的分子结构和组成相似,随着相对分子质量的增加,它们的熔点依次升高 | |
| D. | Cs和Ba分别位于第6周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
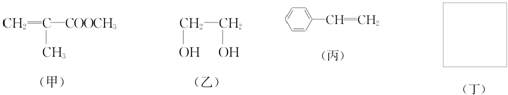
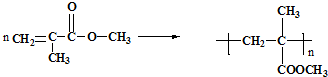
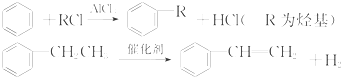 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$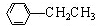 +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化合物中呈+2价 | B. | 氢氧化物呈两性 | ||
| C. | 硫酸盐难溶于水 | D. | 镭比钙的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| B. | 主族元素的原子核外电子最后填入的能级是s能级或p能级 | |
| C. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| D. | 向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的氢氧化铜沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (C6H10O5)n | B. | CH3CH2OH | C. | CH3COOH | D. | CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 | |
| B. | 苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 | |
| C. |  和 和 属于同一种物质,不能用来解释甲烷是一种正四面体结构 属于同一种物质,不能用来解释甲烷是一种正四面体结构 | |
| D. | 1mol CH3CH2OH与Na完全反应只生成0.5 mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com