
分析 根据n=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$、N=nNA,结合分子的组成进行计算;.
解答 解:已知在标准状况下,某气体的体积为33.6L,气体的物质的量是$\frac{33.6L}{22.4L/mol}$=1.5mol;若是CO2气体,则该气体的质量是m=nM=1.5mol×44g/mol=66g;
若是CO和CO2气体总中质量为58克,设为CO为xmol,CO2为ymol,
则$\left\{\begin{array}{l}{x+y=1.5mol}\\{28x+44y=58g}\end{array}\right.$,解得:x=0.5mol,y=1mol,则氧原子个数是(0.5mol+2mol)NA=2.5NA,混合气体中碳氧原子个数比为(0.5+1):(0.5+2)=3:5;
故答案为:1.5mol;66g;2.5NA;3:5.
点评 本题考查了物质的量的有关计算,明确各个物理量之间的关系是解本题关键,根据公式来分析解答即可,难度不大,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
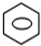 +HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$
+HNO3(浓)$→_{50-60℃}^{浓H_{2}SO_{4}}$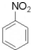 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③①②⑤ | B. | ④⑤③②① | C. | ④③②①⑤ | D. | ④②③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗相同质量的硫酸 | B. | 消耗相同质量的锌 | ||
| C. | 消耗相同质量的氧化铜 | D. | 生成的硫酸锌质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜放入稀硫酸中:Cu+2H+═Cu2++H2↑ | |
| B. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 金属铁溶于稀硫酸中:2Fe+6 H+═2 Fe3++3 H2↑ | |
| D. | 向硫酸溶液中加入氢氧化钡溶液:SO42++Ba2+═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe→FeCl3 | B. | SiO2→Na2SiO3 | C. | Al2O3→Al(OH)3 | D. | NaO→Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.
,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法取试样X于试管中,加入足量新制氢氧化铜悬浊液加热,出现砖红色沉淀后取上清液滴加适量稀硫酸,再加入溴水,若溴水褪色,说明X中含有碳碳双键,写出X与银氨溶液发生的离子反应方程式CH2=CHCHO+2Ag(NH3)2++2OH-$\stackrel{△}{→}$CH2CHCOO-+NH4++2Ag↓+3NH3+H2O.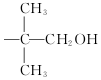 基团;
基团;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com