
| A. | 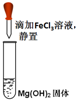 验证沉淀转化 | B. | 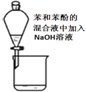 除去苯中的苯酚 | ||
| C. |  观察铁的吸氧腐蚀 | D. |  检验乙炔的还原性 |
分析 A.白色沉淀转化为红褐色沉淀;
B.苯酚与NaOH反应后,与苯分层;
C.NaCl溶液为中性,发生吸氧腐蚀;
D.反应生成的乙炔中混有硫化氢,均能被高锰酸钾氧化.
解答 解:A.白色沉淀转化为红褐色沉淀,则可说明沉淀的转化,故A正确;
B.苯酚与NaOH反应后,与苯分层,然后利用图中分液漏斗分离,故B正确;
C.NaCl溶液为中性,发生吸氧腐蚀,则右侧试管中导管内红墨水上升,故C正确;
D.反应生成的乙炔中混有硫化氢,均能被高锰酸钾氧化,不能检验乙炔的还原性,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及实验装置的作用为解答的关键,侧重分析与应用能力的考查,注意反应原理的分析与应用,题目难度不大.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:解答题
 现有前四周期元素A、B、C、D、E,原子序数依次增大.A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍.基态B原子与A同周期,p能级达到半充满.C原子电子层数与最外层电子数相等.B和E同主族,基态D原子的价层电子排布通式为ns2np1.
现有前四周期元素A、B、C、D、E,原子序数依次增大.A的基态原子核外电子占据3个能级,最外层电子数是电子层数的2倍.基态B原子与A同周期,p能级达到半充满.C原子电子层数与最外层电子数相等.B和E同主族,基态D原子的价层电子排布通式为ns2np1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.铝热反应 | B.燃料燃烧 | C.酸碱中和反应 | D.Ba(OH)2•8H2O与NH4Cl固体混合 |
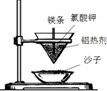 |  | 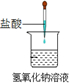 | 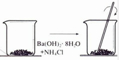 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫具有漂白性,能使氯水褪色 | |
| B. | 浓硫酸具有较强酸性,能使Cu转化为Cu2+ | |
| C. | 硅具有还原性,一定条件下能将铁从其氧化物中置换出来 | |
| D. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 8:1 | B. | 2:1 | C. | 3:2 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )
Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
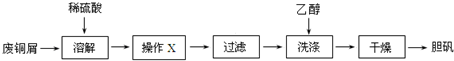
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com