
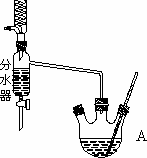
下图为制取乙酸乙酯的实验装置图。回答下列问题:

(1)揭示实验原理
①乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
②能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
(2)反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
(3)实验装置的比较:
利用如图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是__________________________。
(4)酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是____________________________。
(1)① (2分)
(2分)
②否。醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基。(各1分,共2分)
(2)反应速率低,达不到催化剂活性温度;温度过高利于平衡逆向移动,酯产率降低。(各2分,共4分)
(3)用分水器能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率。(合理即给分 2分)
(4)酚酞。碳酸钠层呈红色,上层的酯层呈无色。(各1分,共2分)
【解析】
试题分析:
(1)酯化反应中羧酸提供羟基,醇应该氢原子,所以反应的机理可以表示为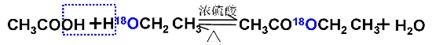 。
。
(2)由于醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基,因此不能用氢同位素示踪法揭示酯化反应原理。
温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃;正反应是放热反应,温度过高利于平衡逆向移动,酯产率降低,所以也不能高于85℃。
(3)根据装置图的结构特点可判断,用分水器能够在反应进行时很容易的把水分离出来,从而降低生成物浓度。使平衡正向移动,提高乙酸乙酯的产率。
(4)由于碳酸钠溶液显碱性,能使酚酞试液显红色,所以应该滴入酚酞试液,实验现象是碳酸钠层呈红色,上层的酯层呈无色。
考点:考查酯化反应原理的探究、外界条件对反应速率和平衡对影响以及实验评价


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
 “酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示装置制取乙酸乙酯.
“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示装置制取乙酸乙酯.| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源:上海市徐汇区2013年高考一模试卷化学试题 题型:043
下图为制取乙酸乙酯的实验装置图.回答下列问题:
1.揭示实验原理
①乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯.请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式________.
②能否用氢同位素示踪法揭示酯化反应原理?________(选填“能”或“不能”),原因是________.
2.反应温度确定:
合成乙酸乙酯的反应为放热反应.实验表明,反应温度应控制在85℃左右为宜.回答:
实验温度不宜低于85℃左右的原因是________;
实验温度不宜高于85℃左右的原因是________;
3.实验装置的比较:利用图中装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是________.
4.酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴________试液,现象是________.
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖南凤凰县华鑫中学高一下学期第三次月考(文)化学卷(解析版) 题型:实验题
(12分)下图是实验室制取乙酸乙酯的实验装置。请回答:

(1)在M试管中加碎瓷片的作用是 。
试管N中盛放的溶液是_________________ 。
该溶液的作用为中和乙酸,吸收挥发出的乙醇, ;
导管在其 液面上而不插入液面下的原因是 。
(2)在大试管中配制一定比例的乙醇、浓硫酸和乙酸
混合液时,加入试剂的顺序是 。
(3)浓硫酸的作用是 。
(4)反应结束后,试管N内的液体分成两层,反应生成的乙酸乙酯在 层(填写“上”或“下”)。若分离N中的液体混合物需要用到的玻璃仪器是烧杯、 。
(5)M试管中发生反应的化学方程式 。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,
就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯
化反应已达到化学平衡状态的是 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
查看答案和解析>>
科目:高中化学 来源:2013届度北京五中高二第一学期期中考试化学(文)试卷 题型:填空题
(6分)某同学为制取乙酸乙酯,在试管A中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸,按下图所示连接好装置进行实验。请回答:

(1) 试管B中盛放的溶液是_________________。
(2) 实验完成后,试管B的液面上有透明的不溶于水的油状液体产生。 若分离该液体混合物需要用到的玻璃仪器是____________。
(3)乙醇与乙酸反应的化学方程式_____________________;实验室中用30 g乙酸与46 g乙醇反应,如果实际产率是理论产率的60%,则可得到的有机产物的质量是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com