
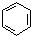
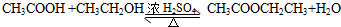 .
.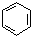 在浓硫酸作用下,与浓硝酸反应的化学方程式为
在浓硫酸作用下,与浓硝酸反应的化学方程式为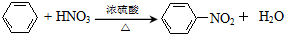 .
. 分析 (1)B中含-COOH;
(2)只有乙烯含碳碳双键,与溴发生加成反应,使其褪色;
(3)乙酸与乙醇发生酯化反应;
(4)苯与浓硝酸发生取代反应生成硝基苯.
解答 解:(1)B中含-COOH,名称为羧基,故答案为:羧基;
(2)能使溴的四氯化碳溶液褪色反应的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,该反应为 加成反应,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;加成反应;
(3)乙酸能与乙醇发生酯化反应的化学方程式为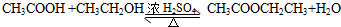 ,
,
故答案为: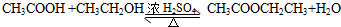 ;
;
(4) 在浓硫酸作用下,与浓硝酸反应的化学方程式为
在浓硫酸作用下,与浓硝酸反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的结构与性质及有机反应,为高频考点,把握官能团与性质的关系、有机反应条件为解答的关键,侧重分析与应用能力的考查,注意有机反应的条件,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 溶液的c(H+)=10-7 mol/L | B. | 溶液的溶质为盐 | ||
| C. | 溶液中既含有H+又含有OH- | D. | 混合溶液中,pH=-$\frac{lg{K}_{w}}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | CO32-VSEPR模型名称与离子的立体构型名称不一致 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


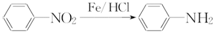 (苯胺,易被氧化)
(苯胺,易被氧化)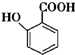 不可选用的试剂有c(填标号).
不可选用的试剂有c(填标号).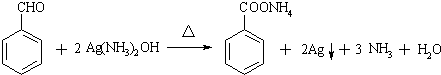 ;若F为高分子化合物,则反应⑦的化学方程式为n
;若F为高分子化合物,则反应⑦的化学方程式为n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$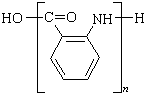 +(n-1)H2O.
+(n-1)H2O.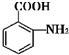 的合成路线流程图(无机试剂任用).合成路线流程图示例如下(已知
的合成路线流程图(无机试剂任用).合成路线流程图示例如下(已知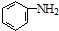 容易被氧化剂氧化):
容易被氧化剂氧化):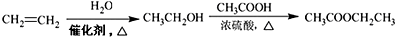 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaCl溶液中Cl-的数目为0.1NA | |
| B. | 16g O2和O3的混合气体中所含的氧原子数为NA | |
| C. | 22.4L H2中含有的氢原子数一定为2NA | |
| D. | 1mol Cl2与过量的金属钠充分反应后,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 密度 (g•mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 苯甲酸 | 1.2659 | 122.13 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有 机溶剂 |
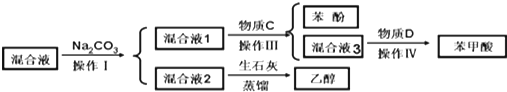
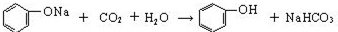 .
.| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加BaCl2, 振荡,静置 | 产生白色沉淀,BaCO3 |
| ②取少量步骤①上层清夜于试管,滴加0.1mol/L盐酸再将产生的气体通入澄清石灰水中 | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加0.1mol/L FeCl3溶液,振荡 | 溶液不显紫色, 说明混合液1不含有酚羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com