
【题目】有A、B两种烃,它们的组成相同,都约含85.7%的碳,烃A对氢气的相对密度是28;烃B的式量是烃A的一半,烃A、B都能使溴的四氯化碳溶液褪色,根据以上实验事实回答问题。
(1)推断A、B两烃的分子式:A ;B 。
(2)A、B中(填“A”或“B”)存在同分异构体,同分异构体的名称是 、 、 、 。(有多少写多少)
(3)写出B与溴的四氯化碳溶液反应的化学方程式: 。
【答案】
(1)A:C4H8;B:C2H4;
(2)A;1-丁烯;顺-2-丁烯;反-2-丁烯;2-甲基-1-丙烯;
(3)CH2=CH2+Br2 → BrCH2CH2Br
【解析】
试题分析:(1)烃A对氢气的相对密度是28,所以烃A的相对分子质量为28×2=56,碳元素的质量分数为86%,所以烃A中C原子数目为![]() =4,所以烃A中H原的数目为
=4,所以烃A中H原的数目为![]() =8,所以烃A的分子式为C4H8;A、B的最简式相同,B式量是烃A的一半,故B的分子式为C2H4,故答案为:C4H8;C2H4;
=8,所以烃A的分子式为C4H8;A、B的最简式相同,B式量是烃A的一半,故B的分子式为C2H4,故答案为:C4H8;C2H4;
(2)A为C4H8,能使溴的四氯化碳溶液褪色,说明分子中含有1个C=C双键,属于烯烃,其同分异构体有:1-丁烯、顺-2-丁烯;反-2-丁烯、2-甲基丙烯,故答案为:1-丁烯、顺-2-丁烯;反-2-丁烯、2-甲基丙烯;
(3)B的分子式为C2H4,能使溴的四氯化碳溶液褪色,则B为乙烯CH2=CH2,与乙烯反应的方程式为:CH2=CH2+Br2→CH2Br-CH2Br,故答案为:CH2=CH2+Br2→CH2Br-CH2Br.


科目:高中化学 来源: 题型:
【题目】相同温度下,两种氨水A、B,浓度分别是0.2 mol/L和0.1 mol/L,则A和B的OH-浓度之比
A. 大于2 B. 小于2 C. 等于2 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子结构如下表示:CH3-C≡C-CH=CH——CH3,该分子中最多可以有多少个原子共平面( )
A.18 B.20 C.22 D.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO + H++Cl-K2=10-3.4
HClO + H++Cl-K2=10-3.4
HClO![]() H++ ClO-Ka=?
H++ ClO-Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )

A. Cl2(g)+ H2O![]() 2H++ ClO-+ Cl-K=10-10.9
2H++ ClO-+ Cl-K=10-10.9
B. 在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
D. 氯处理饮用水时,在夏季的杀菌效果比在冬季差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
A. 无水硫酸铜、蔗糖 B. 硅胶、硫酸亚铁
C. 食盐、硫酸亚铁 D. 生石灰、食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要的催化剂和合金材料。
(1)基态V原子的价层电子排布式为________,其中排布时能量最高的电子所占据能级的原子轨道有________个仲展方向。
(2)VO2+与 可形成配合物。
可形成配合物。 中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
(3)镍形成的[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子中N原子的价层电子对数目为______。与CN-互为等电子体的一种分子的化学式为__________。
(4)La-Ni合金是重要的储氢材料,储氢后的晶胞如图所示。

①合金中,1个La原子周围距离最近且相等的La原子数目为_______。
②含有1mol Ni原子的合金中储存H2的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(有毒性,市场上很易与食盐浞淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似。相关转化关系如图,下列说法不正确的是()
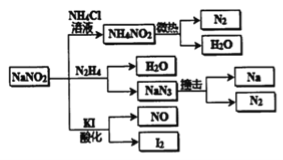
A.NaNO2在水中的溶解性大于NH4NO2
B.NaNO2与N2H4反应中,NaNO2是氧化剂
C.可用KI、淀粉和食醋鉴别NaNO2和NaCl
D.分解NaN3盐每产生1 mol N2转移6 mol e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com