
乙二酸(H2C2O4)俗名草酸,草酸易溶于水,市售消字灵一般为高锰酸钾和草酸的混合溶液。
(1) 在KMnO4与H2C2O4反应中,可通过测定____________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:_______________ _____________;
(2) 某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,H2C2O4水溶液可以用酸性KMnO4溶液进行滴定
该组同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③已知用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,逐滴加入到装有草酸溶液的锥形瓶中,到滴定终点时,停止滴定。开始时读数及恰好反应时KMnO4溶液的读数见下表。
| 实验编号 | 待测草酸溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) |
| ① | 25.00 | 0.00 | 10.00 m |
| ② | 25.00 | 1.00 | 11.02 |
| ③ | 25.00 | 0.22 | 12.00 |
请回答:滴定时,将KMnO4标准液装在 (填“酸式滴定管”或“碱式滴定管”)中。
请在下面空白处通过上述数据,计算出待测的草酸的物质的量浓度 mol/L。计算出x= 。若滴定终点时俯视滴定管刻度,则由此测得的x值会 ;若滴定后,滴定关尖嘴处有气泡,则由此测得的x值会 。填“偏大”、“偏小”或“不变”)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
H![]() CaC2O4↓(白色)+2H2O
CaC2O4↓(白色)+2H2O
为探究乙二酸晶体(H

回答下列问题:
(1)乙二酸晶体(H
(2)a处试剂的名称是________________,反应一段时间后a处的现象为____________。
(3)足量澄清石灰水的作用是________________。
装置乙不能缺少,理由是_________________。
(4)丙中b处逸出的气体可能是________________。检验的方法是_______________(用化学方程式表示)。
(5)简述检查上述装置气密性的方法:__________________。
(6)乙二酸还可能具有的性质是_________________。(填序号)
A.能与银氨溶液发生银镜反应 B.能使酸性KMnO4溶液褪色
C.能与Na2CO3反应生成CO2 D.能使蓝墨水褪色
查看答案和解析>>
科目:高中化学 来源:2011届辽宁省沈阳二中高三第五次模拟考试(理综)化学部分 题型:实验题
某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物(水除外),他们设计的实验装置如下图所示: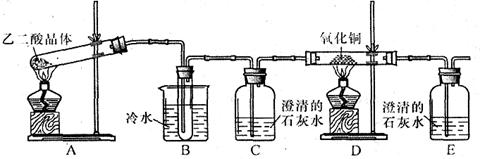
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式: ;
(2)装置B的作用是 ;指出上述装置中的不足之处: 。
(3)实验结束后向装置B的试管中加入少量酸性重铬酸钾溶液,可以观察到的实验现象是溶液由橙色变为绿色(Cr3+),反应的离子方程式为 。
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物。实验小组进一步探究:
①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是 。
②取该红色固体与足量的稀硝酸反应,写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通、泰州、扬州连云港淮安高三第三次调研5月测试化学卷(解析版) 题型:填空题
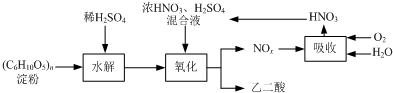
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:
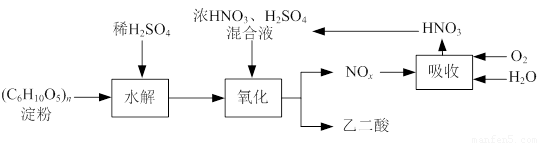
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
⑴检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
⑵氧化时控制反应液温度为55~60℃的原因是 。
⑶若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
⑷生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省高三5月模拟考试(理综)化学部分 题型:实验题
某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如下图所示:
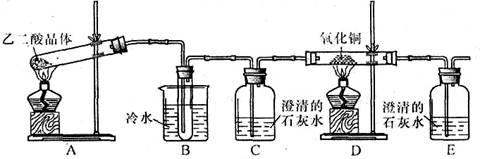
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式: ;
(2)装置B的作用是 ;上述装置中有两处需要改进(假设洗气装置每次吸收气体均完全),改进方法是 ; 。
(3)实验结束后向装置B的试管中加入NaHCO3溶液,产生大量无色气体,由此可以证明两种物质的酸性强弱顺序是 。
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物。实验小组进一步探究:[来源:Zxxk.Com]
①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是 。
②取6.8g红色固体与足量的稀硝酸反应,收集到标准状况下的NO气体1.12L。则红色固体中含单质铜的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com