
| A. | 发酵粉就是NaHCO3,使用它可使生产的食品疏松可口 | |
| B. | 燃煤中添加适量的CaO,有利于降低酸雨形成的概率 | |
| C. | 放置较久的红薯比新挖出土的甜,可能与葡萄糖的水解有关 | |
| D. | 用液溴来吸收香蕉产生的乙烯,达到保鲜的目的 |
分析 A.把NaHCO3作为发酵粉使用时,往往加入少量的明矾;
B.CaO与二氧化硫反应;
C.葡萄糖为单糖,不能水解;
D.溴有毒,不能用于水果保鲜.
解答 解:A.发酵粉是一种复合添加剂,主要用作面制品和膨化食品的生产,把NaHCO3作为发酵粉使用时,往往加入少量的明矾,故A错误;
B.向煤中掺入生石灰,在氧气参与反应和高温的条件下,用来吸收SO2,只生成硫酸钙,可以减少SO2的排放,故B正确;
C.葡萄糖不能水解,淀粉水解生成葡萄糖,故C错误;
D.用高锰酸钾溶液吸收水果产生的乙烯,能达到保鲜的目的,溴有毒,故D错误.
故选B.
点评 本题考查物质的性质及应用,为高频考点,侧重于分析与应用能力的考查,注意把握物质的性质、发生的反应、化学与生活的关系为解答该题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY | |
| B. | 若a=b,并测得溶液中c(X-)=c(Y-)+c(HY)(c(HY)≠0),则相同浓度时,酸性HX>HY | |
| C. | 若a>b,并测得溶液中c(HX)=c(HY),则可推出溶液中c(X-)>c(Y-),且相同浓度时,酸性HX>HY | |
| D. | 若两溶液等体积混合,测得溶液中c(X-)+c(Y-)+c(HX)+c(HY)=0.1 mol/L,则可推出a+b=0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
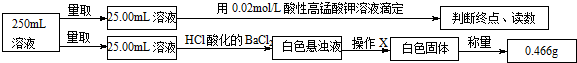
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数大小顺序为Z>Y>X | B. | W、X的简单离子能抑制水的电离 | ||
| C. | 单质的熔点大小顺序为X>W>Y | D. | 原子半径大小顺序为X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 稀释浓硫酸时把水沿着烧杯内壁缓慢注入浓硫酸中,并用玻璃棒搅拌 | |
| B. | 称量2.0gNaOH固体时先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 | |
| C. | 用装置甲除去乙烯中少量SO2气体 | |
| D. | 用装置乙分液,从分液漏斗下口放出有机相,关闭活塞再从分液漏斗上口倒出水相 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com