
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
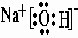 ,氢氧化铝具有两性,故答案为:HClO4;
,氢氧化铝具有两性,故答案为:HClO4;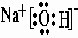 ;Al;
;Al;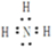 ,氨气中的氢原子和氧原子间是共价键,属于共价化合物,故答案为:NH3;
,氨气中的氢原子和氧原子间是共价键,属于共价化合物,故答案为:NH3;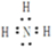 ;共价;
;共价; ,故答案为;S;
,故答案为;S; ;
; ,
, .
.


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液,看紫红色是否褪去 |
| C | 确定碳、氯两元素非金属性的强弱 | 测定同温同浓度的Na2CO3和NaClO水溶液的pH |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
| ⑨ | ⑩ | ||||||||||||||||
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:
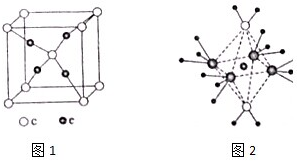 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
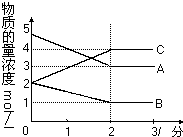 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如右图所示(各物质均为气体).
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如右图所示(各物质均为气体).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24.4g |
| B、13.2g |
| C、12.5g |
| D、11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温下,在0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )
室温下,在0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )| A、a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-?Al(OH)3 |
| B、a-b段,溶液pH增大,Al3+浓度不变 |
| C、b-c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| D、d点时,Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
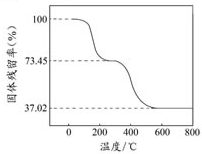 碱式碳酸铝镁[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃剂.
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d?xH2O]常用作塑料阻燃剂.| 固体样品的剩余质量 |
| 固体样品的起始质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com