
对某酸性溶液(可能含有Br-、SO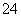 、H2SO3、NH
、H2SO3、NH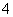 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是 ( )
A.Br- B.SO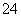
C.H2SO3 D.NH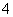
科目:高中化学 来源: 题型:
下列有关除杂质(括号中为杂质)的操作中,不正确的是
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
C.苯(苯酚):加溴水,振荡,过滤除去沉淀
D.溴乙烷(乙醇):多次加水振荡,分液,弃水层
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的+1价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。反应(II)是海水提溴过程中涉及的重要反应。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
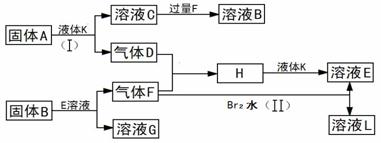
试回答:
(1)甲元素的名称为 ,溴元素在周期表的位置 ,丁元素的阴离子结构示意图为 。
(2)A的电子式为 ,所含化学键类型为 。
(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示) 。
(4)反应(I)的化学方程式为 。
(5)反应(II)的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2分别通入下表所列的溶液中,填写有关问题。
| 反应物 | 溴水 | 酸性 KMnO4 溶液 | 氢硫酸 (H2S溶液) | 滴有酚酞的 NaOH溶液 | 石蕊试液 | 品红 溶液 |
| 反应现象 | 褪色 | 褪色 | 有淡黄色 沉淀生成 | 褪色 | 变红 | 褪色 |
| SO2的性质 | 还原性 | 还原性 | 氧化性 |
| 酸性 | 漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组计划研究当地酸雨的形成过程,于是取来雨水作水样进行测定,随时间的推移,多次测定该样品的pH,得到如下数据:
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)雨水样品放置时pH变化的主要原因为______________________________________
(用化学方程式表示 )。由此可以得出酸雨的形成过程可能是_______________________。
)。由此可以得出酸雨的形成过程可能是_______________________。
如果将刚取样的上述雨水和自来水相混合,pH将______(填“增大”、“减小”或“不变”),原因是________________________ __________________________________,
__________________________________,
二氧化硫表现________性。
(2)下面是酸雨给人类造成的危害,其中不正确的是___________________________。
A.腐蚀建筑物、雕塑等 B.污染水源
C.改良碱性土壤 D.损害庄稼
(3)你认为减少酸雨产生的途径可采取的措施是_____________________________。
①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施或叙述不合理的是 ( )
A.用SO2漂白纸浆和草帽辫 (2013·广东理综,11A)
B.用硫酸清洗锅炉中的水垢 (2013·广东理综,11B)
C.将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性
(2013·广东理综,23A)
D.Na2SO3与H2O2的反应为氧化还原反应 (2013·天津理综,1B)
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R<W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和
H2O为原料制备二甲醚和甲醇的工业流程如下:

请填空:
(1)一定条件下,反应室1中发生反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
其它条件不变,只降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
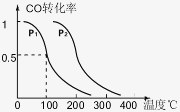 (2)反应室3(容积可变的密闭容器)中 0.2molCO与
(2)反应室3(容积可变的密闭容器)中 0.2molCO与
0.4molH2在催化剂作用下发生可逆反应生成甲醇:
CO(g)+2H2(g) CH3OH(g),CO的平衡转化率
CH3OH(g),CO的平衡转化率
与温度、压强的关系如右图所示,则:
①P1 P2 (填“<”、“>”或“=”)。
②在压强P1下,100℃时反应达到化学平衡,反应室3的容积变为2L,此时 若温度不变,再加入1.0molCO后重新达到平衡,CO的平衡转化率 (填“增大”、“不变”或“减小”)。
③保持容积为2L不变,温度100℃不变,向反应室3中再通入0.2molCO与0.4molH2, CO的平衡转化率 (填“增大”、“不变”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com