
已知反应2H2(g)+CO(g)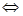 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
| 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |
| K | 2.50 | 0.34 | 0.15 |
A
解析试题分析:A、温度相同,平衡常数相同,不同温度时,CO的转化率越大,平衡向右移动,平衡常数越大,所以K(a)>K(c),K(b)=K(d),正确;B、根据表中数据,温度越高,平衡常数越小,平衡向左移动,说明正反应为放热反应,所以T1 < T2 < T3,则反应速率v(a)<v(c),b、d点温度相同,b点压强大于d,所以v(b)>v(d),错误;C、因为v(a)<v(c),v(b)>v(d),所以达到平衡所需时间:t(a)>t(c),t(b)<t(d),错误;D、平衡向右移动,气体的物质的量减小,平均相对分子质量增大,所以M(a)>M(c),错误。
考点:本题考查化学反应速率和化学平衡移动。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:单选题
1000℃时,FeO(s) + H2 Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
| A.1.0 | B.2.0 | C.3.0 | D.4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:4NH3(g)+5O2(g) == 4NO(g)+6H2O(g) △H="-1" 025kJ/mol,该反应是一个可逆反应。若反应物 起始物质的量相同,下列关于该反应的示意图不正确的是( )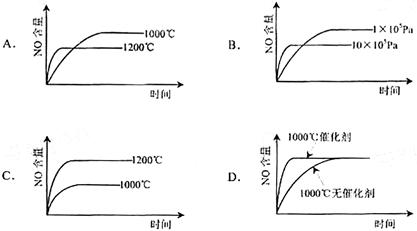
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应:2NO2(g) 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是 ( )
| A.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加 |
| B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO +3HSO
+3HSO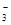 ===3SO
===3SO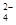 +Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。上图为用ClO
+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。上图为用ClO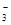 在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )
在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )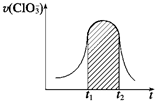
| A.反应开始时速率增大可能是c(H+)增大引起的 |
| B.纵坐标为v(H+)的速率—时间曲线与图中曲线能完全重合 |
| C.后期反应速率下降的主要原因是反应物的浓度减小 |
| D.图中的阴影部分“面积”为t1~t2时间内ClO的物质的量浓度的减小值 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将1 mol A2和1 mol B2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2A2(g)+B2(g) 2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新 达到平衡后,A2B的物质的量
2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新 达到平衡后,A2B的物质的量
| A.小于0.15 mol | B.等于0.3 mol |
| C.等于0.15 mol | D.大于0.15 mol,小于0.3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化学反应限度的叙述中正确的是( )
| A.化学反应的限度都相同 |
| B.可以通过改变反应条件控制化学反应的限度 |
| C.可以通过延长化学反应的时间改变化学反应限度 |
| D.当一个化学反应在一定条件下达到限度时反应即停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知N2O4(g)?2NO2(g) △H>0且平衡体系的总质量(m总 )与总物质的量(n总)之比在不同温度下随压强变化曲线如图所示,下列说法正确的是( )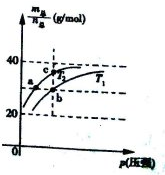
| A.平衡常数K(a)=K(b)<K(c) |
| B.反应速率:va<vb; |
| C.温度:T2>T1 |
D.当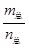 =69g/mol时,若n(NO2):n(N2O4)=2:1, =69g/mol时,若n(NO2):n(N2O4)=2:1, |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com