
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
分析 ①如果苯是单双键交替的结构,则含有的额碳碳双键能被高锰酸钾氧化;
②单、双键不同,键长不相等;
③苯能和氢气加成恰好能说明苯是不饱和的结构;
④如果苯是单双键交替的结构,则邻二甲苯应有两种结构;
⑤根据碳碳双键的性质判断;
解答 解:①苯不能使酸性高锰酸钾溶液褪色,说明苯分子中不含碳碳双键,可以证明苯环结构中不存在C-C单键与C=C双键的交替结构,故①正确;
②苯环上碳碳键的键长相等,说明苯环结构中的化学键只有一种,不存在C-C单键与C=C双键的交替结构,故②正确;
③与氢气加成是苯和双键都有的性质,因此苯能在一定条件下跟H2加成生成环己烷,不能证明苯环中存在单双键交替结构,故③错误;
④如果是单双键交替结构,邻二甲苯的结构有两种,一种是两个甲基夹C-C,另一种是两个甲基夹C=C.邻二甲苯只有一种结构,说明苯环结构中的化学键只有一种,不存在C-C单键与C=C双键的交替结构,故④正确;
⑤苯不因化学变化而使溴水褪色,说明苯分子中不含碳碳双键,可以证明苯环结构中不存在C-C单键与C=C双键的交替结构,故⑤正确.
所以①②④⑤可以作为苯分子中不存在单、双键交替排列结构的证据.
故选C.
点评 本题考查苯的结构与性质,难度不大,综合性较大,要求学生知识掌握全面,能运用知识分析和解决问题,重在能力的考查.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
 原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )
原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )| A. | 两分子原硅酸脱去一分子水得到的H6Si2O7分子中有6个Si-O键 | |
| B. | 两个硅氧四面体,彼此用一个角氧相连后,形成的Si2O76-离子中各键角均为109°28′ | |
| C. | 3个硅氧四面体彼此用3个角氧相连后,形成的Si3O96-离子呈链状 | |
| D. | n个硅氧四面体彼此用四个角氧连接后的晶体是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 | |
| B. | 检验酒精中的少量水:向酒精中加入足量生石灰 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. |  证明溴乙烷与NaOH醇溶液共热生成乙烯:用如右图所示的实验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
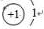 ,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H
,C在周期表中的位置是第二周期第ⅤA族,从结构角度判断A2应比C2活泼 (填稳定或活泼)理由是氮氮三键的键能大于H-H ,其中含有的化学键类型是离子键和共价键
,其中含有的化学键类型是离子键和共价键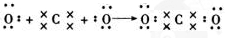 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充分加热至沸腾 | B. | 加入乙醛太少 | ||
| C. | 加入NaOH溶液的量不够 | D. | 加入CuSO4溶液的量不够 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
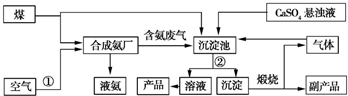
 2NH3.
2NH3. CaCO3↓+(NH4)2SO4.
CaCO3↓+(NH4)2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com