
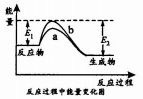
| A. | △H=+|E1-E2| | |
| B. | 曲线a为催化剂时的反应 | |
| C. | X(g)的能量高于Z(g)的能量 | |
| D. | 反应物吸收的总能量大于生成物释放的总能量 |
分析 A.焓变等于正逆反应的活化能之差;
B.催化剂可降低反应所需的活化能;
C.由图可知为放热反应,则2molX与1molY的总能量大于2molE的总能量;
D.放热反应中吸收的能量小于释放的能量.
解答 解:A.焓变等于正逆反应的活化能之差,则△H=E1-E2=+|E2-E1|,故A错误;
B.催化剂可降低反应所需的活化能,则曲线a为催化剂时的反应,故B正确;
C.由图可知为放热反应,则2molX与1molY的总能量大于2molE的总能量,不能确定X、Z的能量大小,故C错误;
D.为放热反应,可知反应物吸收的总能量小于生成物释放的总能量,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、催化剂对活化能的影响为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 离子方程式2Ca2++3HCO3-+3OH-═2CaCO3↓+CO32-+3H2O可以表示NH4HCO3与澄清石灰水反应 | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | n[NH4AlSO4)2]:n[Ba(OH)2]=2:5 时发生的反应为NH4+Al3++2SO42-+2Ba2++5OH-═NH3•H2O+AlO2-+2H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 根据上表得出三种酸电离平衡常数的大小关系为:HF>HClO>H2CO3(一级电离平衡常数) | |
| B. | 加热0.1mol•L-1NaClO溶液其pH,PH小于9.7 | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)═c(F-)>c(H+)=c(OH-) | |
| D. | 0.1 mol•L-1Na2CO3溶液中,存在的关系:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池反应为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,放电时负极质量减轻 | |
| B. | 电解精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | CH3COONa稀溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ 的值增大 | |
| D. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性:Z<X<Y | |
| B. | 原子半径:W>Z>Y | |
| C. | 0.1mol/L溶液pH:X2Z<XW | |
| D. | Z2W2中各原子都达到稳定结构,其电子式是  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
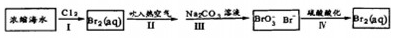
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
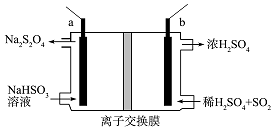 连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是( )| A. | b电极应该接电源的负极 | |
| B. | 装置中所用离子交换膜为阴离子交换膜 | |
| C. | 电路中每转移1mole-消耗SO2的体积为11.2L | |
| D. | a电极的电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
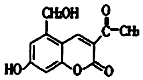 某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )
某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示.下列关于亮菌甲素的说法中,正确的是( )| A. | 亮菌甲素的分子式为C12H12O5 | |
| B. | 1mol亮菌甲素最多能和2molNaOH反应 | |
| C. | 1mol亮菌甲素最多能和4 molH2发生加成反应 | |
| D. | 亮菌甲素在一定条件下可以与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol Na2O2中含有的阴离子数为0.5NA | |
| B. | 等物质的量的OH-与烃基(-OH)所含电子数相等 | |
| C. | 惰性电极电解食盐水,若电路中通过NA个电子,则标况下阳极产生气体11.2L | |
| D. | 25℃时,pH=13的1.0LBa(OH)2溶液中含OH-数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com