
热化学方程式C(s)+H2O(g)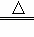 CO(g)+H2(g);△H=+131.3kJ/mol表示( )
CO(g)+H2(g);△H=+131.3kJ/mol表示( )
|
| A. | 碳和水反应吸收131.3kJ能量 |
|
| B. | 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 |
|
| C. | 1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
|
| D. | 1个固态碳原子和1分子水蒸气反应吸热131.1kJ |
考点:
热化学方程式.
专题:
化学反应中的能量变化.
分析:
A、反应热量变化需要说明物质的聚集状态,物质状态不同,反应能量变化不同;
B、反应热量变化需要说明物质的聚集状态,物质状态不同,反应能量变化不同;
C、反应热量变化需要说明物质的聚集状态,物质状态不同,反应能量变化不同;
D、热化学方程式的系数只表示物质的量不表示微粒个数;
解答:
解:A、反应热量变化需要说明物质的聚集状态,物质状态不同,反应能量变化不同;故A错误;
B、反应热量变化需要说明物质的聚集状态,物质状态不同,反应能量变化不同;故B错误;
C、反应热量变化需要说明物质的聚集状态,物质状态不同,反应能量变化不同;故C正确;
D、热化学方程式的系数只表示物质的量不表示微粒个数;故D错误;
故选C.
点评:
本题考查了热化学方程式的书写方法和注意问题,系数只表示物质的量不表示微粒个数是易错点,题目难度中等.


科目:高中化学 来源: 题型:
有平衡体系CO(g)+2H2(g)═CH3OH(g)△H<0,为增加甲醇的产量,应采取的正确措施是( )
|
| A. | 高温、高压 | B. | 适宜的温度、高压、催化剂 |
|
| C. | 低温、高压、催化剂 | D. | 高温、高压、催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒容条件下,能使反应:A(g)+B(g)⇌C(g)+D(g)的正反应速率增大的是( )
|
| A. | 减小C的浓度 | B. | 减小D的浓度 | C. | 减小B的浓度 | D. | 增大A的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在CH3COOH⇌H++CH3COO﹣的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取措施是( )
|
| A. | 加入NaOH | B. | 加入盐酸 | C. | 加水 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
由1mol CO(g)和3mol CH4(g)组成的混合气体在上述条件下充分燃烧,恢复至室温释放的热量为( )
|
| A. | 2912kJ | B. | 2953kJ | C. | 3236kJ | D. | 3867kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO生产甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g).图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图.下列叙述错误的是( )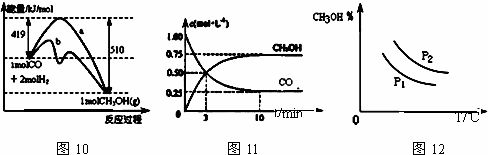
|
| A. | CO和H2合成CH3OH的反应:△H<0,△S>0 |
|
| B. | 保持温度不变,再充入1mol CO和2mol H2,反应达到新平衡时 |
|
| C. | 图10中曲线b可表示使用了催化剂的能量变化情况 |
|
| D. | 图12中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com