
【题目】元素R的气态氢化物化学式为HxR.在标准状况下,8.5gHxR气体的体积是5.6L。将5.1gHxR气体通入200mL0.75mol/L的CuCl2溶液中正好完全反应,并生成黑色沉淀。
(1)求HxR的式量; (2)推断x值,并确定R元素的名称。
【答案】(1)34 (2) 2、 硫
【解析】
(1)根据n=![]() 计算HxR气体的物质的量,再结合M=
计算HxR气体的物质的量,再结合M=![]() 计算相对分子质量;
计算相对分子质量;
(2)5.1gHxR气体的物质的量为0.15mol,CuSO4的物质的量也是0.15mol,二者等物质的量反应,则发生反应:HxR+CuCl2═CuR↓+2HCl,结合原子守恒计算x的值,进而确定R元素。
(1)标况下,HxR气体的物质的量=![]() =0.25mol,则其摩尔质量=
=0.25mol,则其摩尔质量=![]() =34g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为34,
=34g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为34,
答:HxR的相对分子质量为34;
(2)n(HxR)=![]() =0.15mol,而200mL 0.75molL-1的CuCl2溶液中氯化铜的物质的量为:0.2L×0.75molL-1=0.15mol,二者等物质的量反应,则发生反应:HxR+CuCl2═CuR↓+2HCl,由氢元素和氯元素质量守恒可知x=2,则Ar(R)=34-2=32,故R原子的质量数为32,且CuR为黑色沉淀,可推知R为硫元素,
=0.15mol,而200mL 0.75molL-1的CuCl2溶液中氯化铜的物质的量为:0.2L×0.75molL-1=0.15mol,二者等物质的量反应,则发生反应:HxR+CuCl2═CuR↓+2HCl,由氢元素和氯元素质量守恒可知x=2,则Ar(R)=34-2=32,故R原子的质量数为32,且CuR为黑色沉淀,可推知R为硫元素,
答:x为2,R为硫元素。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Na2O、CaO、CuO、Fe2O3和SiO2中的若干种,为确定其成分,现取X进行如下实验(所加试剂均过量),下列说法正确的是
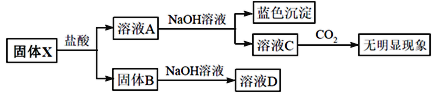
A.该混合物一定含有CuO、SiO2B.该混合物可能含有Na2O和Fe2O3
C.该混合物一定不含CaO和Na2OD.无法确定是否含有CaO和Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复旦大学的王永刚教授研究团队在柔性电池研究方面取得了新突破,发展了一种基于有机物电极材料的柔性水系锌电池。充放电过程中实现了芘四酮(PTO)与PTO-Zn2+的相互转化,原理如图所示。下列说法正确的是
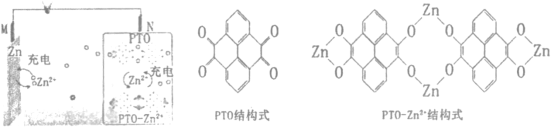
A.放电吋,N电极发生氧化反应
B.放电时,N极的电极反应式为PTO-Zn2+-8e-=2PTO+4Zn2+
C.充电时,M电极与电源负极相连
D.充电时,Zn2+向N极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块擦去氧化膜的铝片放入20 mL 0.5 mol·L-1 CuSO4溶液中,观察实验现象。下列方程式不正确的是
A.Cu2+(aq)+2H2O(l)Cu(OH)2(s)+2H+(aq) △H>0
B.2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s) △H<0
C.Cu(OH)2(s)![]() CuO(s)+H2O(l) △H>0
CuO(s)+H2O(l) △H>0
D.2Al(s)+6H+(aq)=2Al3+(aq)+3H2(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲酸的分解反应:HCOOHCO+H2O,△H。在H+催化作用下反应历程为:
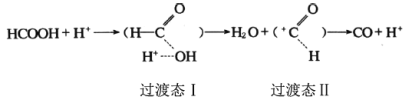
根据过渡态理论,其反应过程中的能量变化如图所示,E1、E2、E3均为大于0。
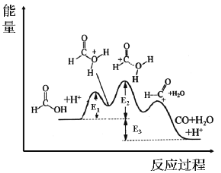
下列说法不正确的是
A.E2为正反应的最高活化能
B.该反应为放热反应,△H=E3
C.图像中第一个峰(过渡态)对应的物质结构为过渡态I
D.使用催化剂后,正逆反应速率同等程度改变,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较金属性的强弱:Na_________K(填“>”、“<”或“=”);反应Na+KClNaCl+K↑能发生的原因是________________。
(2)COCl2是共价化合物,各原子均满足8电子稳定结构。写出COCl2的结构式__________。
(3)电解熔融氧化铝制备金属铝时,需要定期更换阳极石墨块,理由是_________________(用化学反应方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。

①电石与水反应很快,为了减缓反应速率,装置A中除用饱和食盐水代替水之外,还可以采取的措施是__________(写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为______。该过程中,可能产生新的杂质气体Cl2,其原因是: _____________(用离子方程式回答)。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是______________________。
②装置D中生成H2C2O4的化学方程式为____________________________。
③从装置D中得到产品,还需经过_____________(填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是______________________。
②滴定过程中发现褪色速率开始很慢后逐渐加快,分析可能的原因是_______________。
③产品中H2C2O4·2H2O的质量分数为_______________(列出含 m、c、V 的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法错误的是
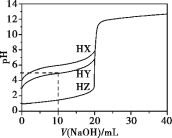
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HX<HY<HZ
B.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
C.根据滴定曲线,可得知Y-的水解常数K约为10-9
D.由图象可知酸碱中和滴定分析不适用于极弱的酸和极弱的碱的测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是
A.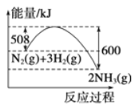 反应达到平衡后,升高温度,平衡常数K值变大
反应达到平衡后,升高温度,平衡常数K值变大
B.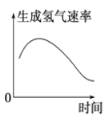 表示镁条放入盐酸中生成氢气速率随时间的变化
表示镁条放入盐酸中生成氢气速率随时间的变化
C.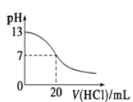 表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D.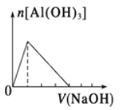 表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com