
分析 海水中含有Br-,经浓缩后通入氯气,发生氧化还原反应生成Br2,在反应后的溶液中通入二氧化硫,又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
(1)海水浓缩的目的是提高Br-的浓度,可节约原理和能源,结合元素化合价判断;
(2)MnO2+4HCl=MnCl2+2H2O+Cl2↑中,1molMnO2反应时氧化剂为1mol,但参加反应的4molHCl中只有2molHCl作还原剂,2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2+Cl2制中H元素化合价降低,Cl元素化合价升高;
(3)a.化合反应不一定为氧化还原反应;
b.氧化还原反应中一定存在元素化合价升降,为氧化还原反应的特征;
c.金属的腐蚀也为氧化还原反应;
d.电子转移可能发生在同一元素之间,如氯气与水的反应;
(4)SO2与溴水反应生成硫酸和HBr.
解答 解:海水中含有Br-,经浓缩后通入氯气,发生氧化还原反应生成Br2,在反应后的溶液中通入二氧化硫,又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
(1)海水浓缩的目的是提高Br-的浓度,可节约原理和能源,反应中SO2、Br-被氧化,氯气为氧化剂,SO2、Br-为还原剂,故答案为:浓度;Cl2;SO2、Br-;
(2)由MnO2+4HCl=MnCl2+2H2O+Cl2↑可知,1molMnO2反应时氧化剂为1mol,但参加反应的4molHCl中只有2molHCl作还原剂,即氧化剂与还原剂的物质的量之比为1:2,
工业上利用反应:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2+Cl2制备氯气,反应中H元素化合价降低,Cl元素化合价升高,转移电子的方向和数目可表示为 ,
,
故答案为:1:2; ;
;
(3)a.化合反应不一定为氧化还原反应,如氧化钠和水的反应,故a错误;
b.氧化还原反应中一定存在元素化合价升降,为氧化还原反应的特征,故b正确;
c.金属的腐蚀也为氧化还原反应,但均对生产生活无益,故c错误;
d.电子转移可能发生在同一元素之间,如氯气与水的反应,故d错误.
故答案为:b;
(4)SO2与溴水反应生成硫酸和HBr酸,化学方程式为SO2+Br2+H2O=H2SO4+2HBr,故答案为:SO2+Br2+H2O=H2SO4+2HBr.
点评 本题考查物质的分离、提纯,侧重于海水的提纯以及氧化还原反应的考查,答题时注意把握物质的性质以及氧化还原反应的分析,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
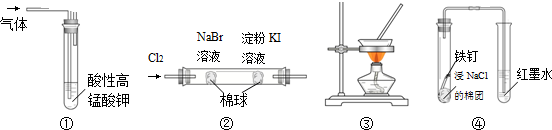
| A. | 图①装置可用于除去甲烷中混有的乙烯 | |
| B. | 图②装置可证明氧化性:Cl2>Br2>I2 | |
| C. | 图③装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 图④装置可观察铁的吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 旋转玻璃塞,使漏斗内外气压相等,故液体顺利流下 | |
| B. | 旋转玻璃塞,使玻璃塞贴合更紧密,故液体顺利流下 | |
| C. | 旋转玻璃塞,使漏斗内气压减小,故液体顺利流下 | |
| D. | 旋转玻璃塞,使漏斗颈内污物脱落,故液体顺利流下 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电子式为: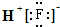 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| D. | Cl-的结构示意图: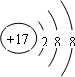 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.同温同压下,物质的物质的量相等,其体积一定相同
B.等体积的二氧化碳和一氧化碳所含的分子数一定相等
C.1L氮气一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com