
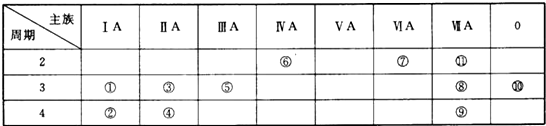

分析 由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为Cl、⑨为Br、⑩为Ar、⑾为F,
(1)稀有气体化学性质最不活泼;该11种元素中,非金属性最强的为F,其次为Cl,由于F没有正化合价,则酸性最强的化合物为高氯酸;元素⑥与⑦形成的化合物为(CN)2,其分子中含有两个C≡N和1个C-N键,据此写出其电子式;
(2)⑧为Cl、⑨为Br,非金属性越强,对应单质的活泼性越强;用卤素单质的相互置换反应,可以证明卤素单质的活泼性;
(3)离子的电子层越多,离子半径越大,电子层相同时,核电荷数越多,离子半径越小;
(4)元素⑧的氢化物为HCl,⑧的单质为氯气,写出浓盐酸与二氧化锰反应生成氯气的化学方程式;
(5)根据质量守恒定律判断另一种产物为氧化铝,然后写出反应的化学方程式.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为Cl、⑨为Br、⑩为Ar、⑾为F,
(1)稀有气体Ar化学性质最不活泼;由于F没有最高正价,则最高价氧化物对应水化物酸性最强的为高氯酸:HClO4;
C、N形成的化合物为氰气,(CN)2结构为N≡C-C≡N,则其电子式为: ,
,
故答案为:Ar;HClO4; ;
;
(2)同主族自上而下非金属性减弱,单质的氧化性减弱,故Br2的氧化性较弱,即氧化性Cl2>Br2,可以利用单质之间的相互置换反应证明,离子方程式为:Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2;根据置换反应反应Cl2+2Br-=2Cl-+Br2可证明单质氧化性Cl2>Br2;
(3)②、③、⑧分别为K、Mg、Cl元素,对应离子为Cl-、K+、Mg2+,离子的电子层越多,离子半径越大,则镁离子的离子半径最小;电子层相同时,核电荷数越大,离子半径越小,则氯离子的离子半径对应钾离子,所以离子半径大小为:Cl->K+>Mg2+,
故答案为:Cl->K+>Mg2+;
(4)⑧为Cl元素,其单质为氯气,氢化物为HCl,实验室中用浓盐酸制取氯气的化学方程式为:4HCl(浓)+MnO₂$\frac{\underline{\;\;△\;\;}}{\;}$MnCl₂+Cl₂↑+2H₂O,
故答案为:4HCl(浓)+MnO₂$\frac{\underline{\;\;△\;\;}}{\;}$MnCl₂+Cl₂↑+2H₂O;
(5)⑤的单质为Al,Al、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),则Al、C、TiO2在高温下反应Al2O3和TiC,该反应方程式为:4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3TiC,
故答案为:4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3TiC.
点评 本题考查元素周期表和元素周期律的综合应用,题目难度中等,熟悉元素周期表的结构及元素的推断是解答本题的关键,并注重利用元素周期律、单质、化合物的性质、化学用语来解答即可.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为制取乙酸乙酯的实验装置图,请回答下列问题:
如图为制取乙酸乙酯的实验装置图,请回答下列问题:| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.7 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )| A. | 电解过程中OH-从a极区通过离子交换膜c进入b极区 | |
| B. | 随着电解进行,KOH溶液浓度会逐渐减小 | |
| C. | 当阳极有0.1mol I-放电时,阴极生成6.72LH2 | |
| D. | a电极反应式:I--6e-+6OH-═IO3-+3H2O,a极区的KI最终转变为KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{64m}{n}$ | B. | $\frac{32m}{n}$ | C. | $\frac{n}{32m}$ | D. | $\frac{n}{64m}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com