
 取20ml 0.1mol/L氨水溶液(其电离常数为K),用0.10mo/L盐酸滴定.滴定过程中溶液PH变化如图所示.图中a、b、c、d四个点所代表的溶液中,c(OH-)≈K的点是( )
取20ml 0.1mol/L氨水溶液(其电离常数为K),用0.10mo/L盐酸滴定.滴定过程中溶液PH变化如图所示.图中a、b、c、d四个点所代表的溶液中,c(OH-)≈K的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
分析 一水合氨的电离平衡常数为:K=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,若c(OH-)≈K,则溶液中c(NH4+)=c(NH3•H2O),滴定未达到终点,此时溶液呈碱性,据此进行解答.
解答 解:一水合氨电离方程式为:NH3•H2O?NH4++OH-,则其电离平衡常数K=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,
若c(OH-)≈K,此时的溶液中c(NH4+)=c(NH3•H2O),而达到滴定终点时恰好生成氯化铵:c(NH4+)>c(NH3•H2O),所以c(OH-)≈K时未达到终点,溶液呈碱性,图象中b点符合,
故选B.
点评 本题考查了酸碱中和滴定及其应用,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握中和滴定实质及操作方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1 | |
| B. | 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 常温下,1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L 盐酸的pH=8.0 | |
| D. | 电解质不一定导电,导电物质不一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用的氢氧化钠固体放置于空气中过久 | |
| B. | 定容时,眼睛俯视刻度线 | |
| C. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| D. | 定容后摇匀,发现液面低于刻度线,不作处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 氧化铝与盐酸:O2-+2H+═H2O | |
| C. | NaOH溶液与小苏打溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O+O2+4e-=4OH- | B. | Fe-2e-=Fe2+ | ||
| C. | 2H++2e-=H2↑ | D. | Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 用100 mL容量瓶配制90mL1mol/L的NaOH溶液 | |
| C. | 用量筒量取5.65mL的浓硫酸 | |
| D. | 用托盘天平准确称取3.2gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
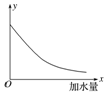
| A. | 溶液中OH-的物质的量浓度 | B. | 溶液的导电能力 | ||
| C. | 溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ | D. | CH3COOH的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com