
【题目】下列叙述中正确的是![]()
A.检验稀盐酸和氢氧化钠溶液是否恰好完全反应,可在反应后溶液中滴加无色酚酞溶液,无明显现象,恰好完全反应
B.某液体可能是海水或蒸馏水,将其蒸发结晶,液体消失,无残留物,该液体为蒸馏水
C.某溶液完全蒸发后无固体残留物,该溶液中一定含硫酸根离子
D.某溶液中加入稀盐酸有气泡产生,该溶液中一定含碳酸根离子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某天然氨基酸M是人体必需的氨基酸之一,其合成路线如下:

已知:
①![]()
![]()
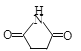
②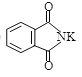 +R—X→
+R—X→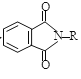 +KX
+KX
(1)A→B的反应条件和试剂是__________________;
(2)I→J的反应类型是______________;
(3)写出G与NaOH水溶液反应的化学方程式________________________________;
(4)化合物M缩聚生成高分子化合物N化学方程式___________;
(5)符合下列条件的化合物M的同分异构体共有__________种(不考虑立体异构);
①含有苯甲酸结构 ②含有一个甲基 ③苯环上只有2个取代基
其中核磁共振氢谱峰面积比为1:1:2:2:2:3的分子的结构简式________________(任写一种);
(6)请写出以丙酸和上述流程中出现的物质为原料经三步合成丙氨酸(![]() )的路线。________________________________________________________________________________
)的路线。________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。工业上可通过以下反应制得ClO2(提示:下面方程式中的氧元素都为负二价)2KClO3+Na2SO3+H2SO4![]() 2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
A. KClO3在反应中是还原剂
B. 制得1mol的ClO2反应中需转移2mol电子
C. Na2SO3的还原性小于ClO2的还原性
D. 反应中被氧化的元素是S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、 Z、W、Q、 M在元素周期表的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是
X | Y | Z | |
W | Q | M |
A. 对应氢化物的沸点Y> Q是因为Y的非金属性比Q强
B. XM4的比例模型为![]() 其二氢取代物有两种
其二氢取代物有两种
C. W的氧化物,常温下可以和Z、M的氢化物反应
D. Z的单质能将Y的单质从他的氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是()
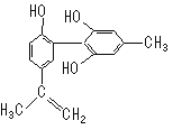
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为3mol、7 mol
D.该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g)+3N(g)![]() xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A. x值为2 B. 混合气体的密度增大
C. N的转化率为80% D. 混合气体平均摩尔质量不变,不能说明该反应达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2g/mL,质量分数为36.5%的浓盐酸配制250mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为__mL。
(2)溶液配制中需要的玻璃仪器有烧杯、玻璃棒、量筒、__、__。
(3)实验过程中,下列操作会导致最终所配溶液浓度偏高的是__。
A.量取浓盐酸时俯视刻度线
B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线
D.转移时,未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)![]() C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)该温度下,该反应的化学平衡常数K=________________。
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是________________,通过计算说明此时,该反应是否达到了平衡状态__________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2=2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。
c(H2)/mol·L-1 | c(Cl2)/mol·L-1 | v/mol·L-1·s-1 |
1.0 | 1.0 | 1.0 k |
2.0 | 1.0 | 2.0 k |
2.0 | 4.0 | 4.0 k |
由此可推得,m、n值正确的是( )
A.m=1,n=2B.m=1,n=![]()
C.m=![]() ,n=1D.m=
,n=1D.m=![]() ,n=
,n=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com