
| A. | 铜的金属活泼性比铁弱,可在海轮外壳上镶入若干铜块以减缓铁腐蚀 | |
| B. | 原电池中,一定由活泼性强的金属作负极,发生氧化反应 | |
| C. | 原电池放电时的负极和电解池充电时的阴极均发生氧化反应 | |
| D. | 可充电电池充电时,负极与电源负极相连,正极与电源正极相连 |
分析 A.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
B.原电池中,一般由活泼性强的金属作负极,发生氧化反应;
C.负极和阳极均失电子发生氧化反应;
D.原电池负极发生氧化反应,充电时,阴极发生还原反应,原电池正极发生还原反应,充电时,阳极发生氧化反应.
解答 解:A.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,铁、铜和海水构成的原电池中,铁易失电子作负极,所以加速被腐蚀,故A错误;
B.原电池中,一般由活泼性强的金属作负极,发生氧化反应,但镁-铝-氢氧化钠原电池,则不活泼的铝为负极,故B错误;
C.负极和阳极均失电子发生氧化反应,则原电池放电时的负极和充电时的阳极均发生失电子的氧化反应,故C错误;
D.原电池负极发生氧化反应,充电时,阴极发生还原反应,可充电电池充电时负极连接外加电源的负极,原电池正极发生还原反应,充电时,阳极发生氧化反应,可充电电池充电时正极连接外加电源的正极,故D正确.
故选D.
点评 本题考查了原电池原理的应用,明确正负极的判断方法及正负极上发生的电极反应即可解答,会根据原电池原理分析金属的腐蚀与防护,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 向0.1 mol•L-1的硫酸中滴入几滴甲基橙溶液,溶液变黄 | |
| B. | 将CH4和乙烯的混合气体通过酸性KmnO4溶液可得纯净的CH4 | |
| C. | 提纯混有乙酸和乙醇的乙酸乙酯,用饱和Na2CO3溶液洗涤、分液并干燥 | |
| D. | 制备Fe(OH)3胶体时,可在FeCl3溶液中加入足量NaOH溶液并煮沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中:K+、SO42-、Cl-、Al3+ | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1.0×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③④ | C. | 全部 | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
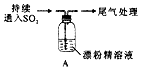 | 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
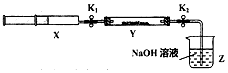
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)淡黄色固体变为白色粉末 | (2)反应的化学方程式:SO2+Na2O2=Na2SO4 |
| 将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)Z中NaOH溶液倒吸入Y管中 | (4)不用解释 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 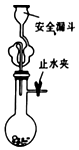 实验室用大理石和盐酸制备二氧化碳 | |
| B. | 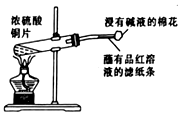 制取SO2、检验SO2的漂白性 | |
| C. | 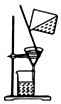 提纯氢氧化铁胶体 | |
| D. | 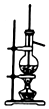 实验室用乙醇和浓硫酸制乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
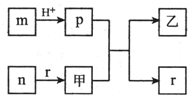 短周期主族元素W、X、Y、Z的原子半径依次增大,且X、Y原子序数之和是W、Z原子序数之和的2倍.m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙均是淡黄色固体.上述物质的转化关系如图所示(部分反应物或生成物省略).下列说法错误的是( )
短周期主族元素W、X、Y、Z的原子半径依次增大,且X、Y原子序数之和是W、Z原子序数之和的2倍.m、n、p、r是由这些元素组成的二元化合物,甲、乙是其中两种元素对应的单质,n与乙均是淡黄色固体.上述物质的转化关系如图所示(部分反应物或生成物省略).下列说法错误的是( )| A. | 热稳定性:p<r | |
| B. | X与Y组成的化合物一定有漂白性 | |
| C. | 含Y元素的盐溶液可能显酸性、中性或碱性 | |
| D. | Z与W、X、Y可形成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com