

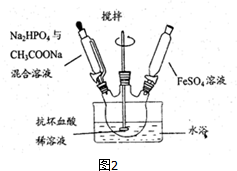
分析 (1)由原料配制溶液时,蒸馏水事先要煮沸、冷却,可以除去溶液中的溶解的氧气,避免氧化Fe2+;
(2)①分别加入药品,混合溶液至PH=4时,再加入FeSO4溶液,防止生成Fe(OH)2沉淀;
②铁粉是固体,混在产品中;
③制备时需不断搅拌,使反应物充分接触,也会防止生成Fe(OH)2沉淀;
(3)生成的Fe3(PO4)2•8H2O 固体混有杂质SO42-离子,通过检验SO42-,判断沉淀洗涤干净与否;
(4)通常用KSCN溶液检验Fe3+;
(5)②重金属硫化物不溶于水,用过量Na2S溶液除去重金属离子,至不再生成沉淀为止;
④已知:Na2HPO4溶液pH8.2~8.4,调节溶液pH8.2~8.4,即得到Na2HPO4•12H2O晶体;
⑤加入乙醇,降低Na2HPO4溶解度,冷却结晶.
解答 解:(1)Fe2+具有强还原性,由原料配制溶液时,蒸馏水事先要煮沸、冷却,可以除去溶液中的溶解的氧气,避免氧化Fe2+;
故答案为:除去溶液中的溶解的氧气;
(2)①实验不是将三种溶液直接混合,分别加入,混合溶液至PH=4时,再加入FeSO4溶液,防止生成Fe(OH)2沉淀;
故答案为:避免生成Fe(OH)2沉淀;
②铁粉是固体,混在产品中,故用抗坏血酸溶液作底液而不用铁粉;
故答案为:避免产品中混有铁粉;
③制备时需不断搅拌,使反应物充分接触,也会防止生成Fe(OH)2沉淀;
故答案为:使反应物充分接触,避免生成Fe(OH)2沉淀;
(3)生成的Fe3(PO4)2•8H2O 固体混有杂质SO42-离子,取最后一滴洗涤滤液1~2mL于试管中,向其滴加BaCl2溶液,若无沉淀产生,则表明已洗涤干净;
故答案为:取最后一滴洗涤滤液1~2mL于试管中,向其滴加BaCl2溶液,若无沉淀产生,则表明已洗涤干净;
(4)通常用KSCN溶液检验Fe3+,取少量固体溶于适量盐酸,然后滴入KSCN溶液,容易变红色,说明含有Fe3+,否则不含;
故答案为:取少量固体溶于适量盐酸,然后滴入KSCN溶液,容易变红色,说明含有Fe3+,否则不含;
(5)②重金属硫化物不溶于水,用过量Na2S溶液除去重金属离子,至不再生成沉淀为止;
故答案为:逐滴滴入Na2S溶液,至不再生成沉淀为止;
④已知:Na2HPO4溶液pH8.2~8.4,用0.1mol/LH3PO4和NaOH溶液调节溶液pH8.2~8.4,即得到Na2HPO4•12H2O晶体;
故答案为:用0.1mol/LH3PO4和NaOH溶液调节溶液pH8.2~8.4;
⑤加入乙醇,降低Na2HPO4溶解度,冷却结晶,析出Na2HPO4•12H2O晶体;
故答案为:加入乙醇,冷却结晶.
点评 本题以铁及其化合物为载体考查了物质的制备,涉及氧化还原反应、实验操作、反应速率的影响因素等知识点,根据物质之间的关系式、实验操作的规范性、影响反应速率的因素等知识点来分析解答,题目难度中等.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:选择题
| A. | 强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2 FeO42-+3Cl-+H2O+4H+ | |
| B. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| C. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-═BaSO4↓+H2O | |
| D. | 把少量碳酸氢钠溶液加入到氢氧化钡溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 熔点:对二甲苯>邻二甲苯>间二甲苯 | |
| D. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷元素的最高化合价为+3 | |
| B. | 砷的气态氢化物比NH3稳定 | |
| C. | 砷的最高价氧化物的水溶液呈强碱性 | |
| D. | 砷原子的第3电子层含有18个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水、酒精和水 | B. | 四氯化碳和水、苯和液溴 | ||
| C. | 硝基苯和水、乙酸和水 | D. | 苯和水、己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某种稀酸溶液,用蒸馏水稀释10倍,其pH一定增大一个单位 | |
| B. | 100℃时的NaCl溶液,PH约为6时呈中性. | |
| C. | pH相同的醋酸和H2SO4分别能恰好中和等物质的量的NaOH | |
| D. | 将0.1mol/L CH3COOH溶液加水稀释10倍,溶液中所有离子的浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融状态下能导电的物质是电解质 | |
| B. | BaSO4虽然难溶,但是强电解质 | |
| C. | NH3的水溶液能导电,所以NH3是电解质 | |
| D. | 弱电解质溶液的导电性比强电解质溶液弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com