
 为了控制燃煤电厂所排放的烟气中氮氧化物,目前常采用选择性催化还原法(SCR)进行脱硝.在其脱硝过程中,V2O5-WO3/TiO2催化剂是决定脱硝效率的关键因素.该催化剂随温度的升高其活性会下降,若在反应前期通入SO2,在催化剂表面氧化并最终形成硫酸,增强了催化剂表面的酸性,从而提高了高温下催化剂的活性,根据以上信息,回答问题:
为了控制燃煤电厂所排放的烟气中氮氧化物,目前常采用选择性催化还原法(SCR)进行脱硝.在其脱硝过程中,V2O5-WO3/TiO2催化剂是决定脱硝效率的关键因素.该催化剂随温度的升高其活性会下降,若在反应前期通入SO2,在催化剂表面氧化并最终形成硫酸,增强了催化剂表面的酸性,从而提高了高温下催化剂的活性,根据以上信息,回答问题:| 1 |
| 2 |
| 1 |
| 2 |
| 2 |
| 0.9 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 0.45 |
| 1 |
| c2(SO 3) |
| c 2(SO 2)c(O 2) |
| (0.9mol/L)2 |
| (0.1mol/L)2×0.55mol/L |
| 催化剂 |
| △ |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
 取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量间的关系如图所示,下列有关说法正确的是( )
取实验室中部分变质的NaOH样品配成溶液,向其中滴加稀盐酸,绘制出生成的CO2的质量与加入的盐酸的质量间的关系如图所示,下列有关说法正确的是( )| A、OA段没有发生任何反应 |
| B、C点的溶液的pH=7 |
| C、B点表示加入的盐酸与原溶液中的溶质恰好完全反应 |
| D、C点溶液中的溶质只有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属原子组成的化合物不可能是离子化合物 |
| B、ⅠA族元素的金属性一定比ⅡA族元素的金属性强 |
| C、同一主族元素组成的化合物一定是共价化合物 |
| D、NH4H中的所有原子的最外层都符合相应稀有气体原子电子层结构,1mol NH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都不正确 |
| B、只有②正确 |
| C、只有④⑤正确 |
| D、只有⑤正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
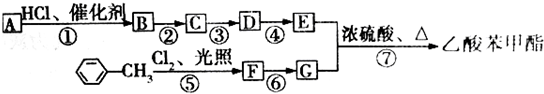
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com