
【题目】N和Si是合成新型非金属材料的两种重要元素.请回答:
(1)基态Si原子的价层电子排布图为;其2p能级的轨道有个伸展方向,电子云的形状为 .
(2)Si原子可形成多种氢化物,其中Si2H4中Si原子的价层电子对数目为 , Si原子的杂化轨道类型为 .
(3)N和Si形成的原子晶体中,N原子的配位数为 .
(4)NaN3常作为汽车安全气囊的填充物,其焰色反应为黄色.大多数金属元素有焰色反应的微观原因为;N3﹣中σ键和π键的数之比为 . B、F与N三种元素同周期,三种基态原子的第一电离能由大到小的顺序为(用元素符号表示).
(5)NaNO2是一种重要的工业原料,NO2﹣的空间构型为 .
(6)SiO2的晶胞与金刚石(如图所示)相似,可以看作Si原子替代C原子后,在两个成键的Si原子间插入1个O原子形成. 
则:①晶胞中最小的环含有个原子.
②若晶体密度为ρgcm﹣3 , 阿伏伽德罗常数为NA , 晶胞中两个最近的Si原子核之间的距离为pm(用代数式表示).
【答案】
(1)![]() ;3;纺锤形
;3;纺锤形
(2)3;sp2
(3)3
(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量;1:1;F>N>B
(5)V形
(6)12;![]() ×1010
×1010
【解析】解:(1)Si为14号元素,价层电子排布图为 ![]() ,2p能级的轨道有3个伸展方向,电子云的形状为纺锤形,所以答案是:
,2p能级的轨道有3个伸展方向,电子云的形状为纺锤形,所以答案是: ![]() ;3;纺锤形;(2)Si2H4中Si原子的价层电子对数目=3且不含孤电子对,其结构和乙烯相似,根据价层电子对互斥理论判断Si原子杂化方式为sp2 , 所以答案是:3;sp2;(3)N和Si形成的原子晶体化学式为Si3N4 , 该物质中每个N原子只能形成3个共价键,所以每个N原子配位数是3,所以答案是:3;(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量,所以大多数金属焰色反应时呈现一定颜色;N3﹣与二氧化碳是等电子体,二者结构相同,每个二氧化碳分子中含有两个σ键和两个π键,则N3﹣中σ键和π键的数之比为1:1;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是F>N>B,
;3;纺锤形;(2)Si2H4中Si原子的价层电子对数目=3且不含孤电子对,其结构和乙烯相似,根据价层电子对互斥理论判断Si原子杂化方式为sp2 , 所以答案是:3;sp2;(3)N和Si形成的原子晶体化学式为Si3N4 , 该物质中每个N原子只能形成3个共价键,所以每个N原子配位数是3,所以答案是:3;(4)电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量,所以大多数金属焰色反应时呈现一定颜色;N3﹣与二氧化碳是等电子体,二者结构相同,每个二氧化碳分子中含有两个σ键和两个π键,则N3﹣中σ键和π键的数之比为1:1;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是F>N>B,
所以答案是:电子从较高能级的激发态跃迁到较低的激发态或基态时,以光的形式释放能量;1:1;F>N>B;(5)NO2﹣中N价层电子对个数=2+ ![]() =3且含有一个孤电子对,根据价层电子对互斥理论判断亚硝酸根离子空间构型为V形,
=3且含有一个孤电子对,根据价层电子对互斥理论判断亚硝酸根离子空间构型为V形,
所以答案是:V形;(6)①根据图知,每个最小环上含有6个Si原子、6个O原子,所以晶胞中最小的环含有12个原子,所以答案是:12;
②金刚石晶胞中4个C原子在晶胞内部,6个C原子在面心上、8个C原子分别位于8个顶点上,所以该晶胞中C原子个数=4+8× ![]() +6×
+6× ![]() =8,该晶胞体积=
=8,该晶胞体积= ![]() cm3 , 晶胞中两个最近的Si原子核之间的距离为晶胞体对角线长度的
cm3 , 晶胞中两个最近的Si原子核之间的距离为晶胞体对角线长度的 ![]() =
= ![]() ×
× ![]() ×
× ![]() cm=
cm= ![]() ×
× ![]() ×
× ![]() cm=
cm= ![]()
![]() cm=
cm= ![]()
![]() ×1010pm,
×1010pm,
所以答案是: ![]()
![]() ×1010 .
×1010 .


科目:高中化学 来源: 题型:
【题目】已知:①2C(s)+O2(g)═2CO(g)△H=﹣220kJmol﹣1②氢气燃烧的能量变化示意图: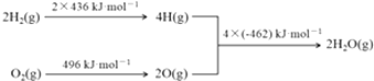
下列说法正确的是( )
A.1molC(s)完全燃烧放出110 kJ的热量
B.H2(g)+ ![]() O2(g)═H2O(g)△H=﹣480 kJ?mol﹣1
O2(g)═H2O(g)△H=﹣480 kJ?mol﹣1
C.C(s)+H2O(g)═CO(g)+H2(g)△H=+130 kJ?mol﹣1
D.欲分解2 mol H2O(l),至少需要提供4×462 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将amL 一氧化氮、bmL 二氧化氮、xmL 氧气混合于同一试管里,将试管口倒插于水中,充分反应后试管内气体全部消失,则用a、b表示的x的代数式是 ( )
A. (a+b)/2B. (2a+b)/3C. (3a+b)/4D. (4a+b)/5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界存在反应:14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4 . 在该反应中( )
A.产物中的SO ![]() 有一部分是氧化产物
有一部分是氧化产物
B.5molFeS2发生反应,有10mol电子转移
C.发生氧化反应和发生还原反应的FeS2之比为7:3
D.14mol CuSO4能氧化5molFeS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(主要成分为乙酰水杨酸)是解热止痛、治疗感冒的药物.它是由水杨酸(邻羟基苯甲酸)与醋酸酐进行酯化反应制得的.其反应原理如下: 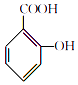 +
+ ![]()
![]()
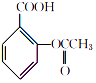 +CH3COOH
+CH3COOH
为避免醋酸酐水解,所用原料、仪器要充分干燥.有关物质的参数如表:
名称 | 式量 | 性质 | 熔点/℃ | 沸点/℃ | 溶解度 | ||
水 | 乙醇 | 乙酸乙酯 | |||||
水杨酸 | 138 | 白色结晶粉末、无臭 | 157~159 | 211 | 溶 | 易溶 | 易溶 |
醋酸酐 | 102 | 无色液体、易燃、有醋酸味 | ﹣73.1 | 138.6 | 易溶 | 溶 | 易溶 |
乙酸水杨酸 | 180 | 白色针状结晶 | 135 | 321.4 | 冰水微溶、热水可溶 | 易溶 | 微溶 |
制取阿司匹林的工艺流程如下:
回答下列问题:
(1)浓磷酸的作用是 . 步骤②的加热方式为水浴加热,温度控制在℃.
(2)向粗产物中加入乙酸乙酯的作用是 .
(3)验证最后得到的乙酰水杨酸产品较为纯净的方法是 .
(4)精制后乙酰水杨酸的质量为8.91g,则其产率为 , 造成产率低的原因可能有(任写一点).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,mg气体A与ng气体B分子数相同,下列说法中不正确的是( )
A.气体A与B的相对分子质量比为m:n
B.同质量气体A与B的分子个数比为n:m
C.同温同压下,同体积A气体与B气体的密度比为n:m
D.相同状况下,同体积A气体与B气体质量比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( ) 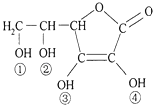
A.维生素C与足量金属钠反应产生氢气是维生素C物质的量的4倍
B.维生素C因为含有酯基而难溶于水
C.维生素C中含有醚键
D.维生素C的酸性可能是③、④两个羟基引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 ℃时某化学反应速率为0.1 mol·L-1·s-1,若温度每升高10 ℃反应速率增加到原来的2倍,为了把该反应速率提高到1.6 mol·L-1·s-1,则该反应需在什么温度下进行( )
A. 30 ℃B. 40 ℃C. 50 ℃D. 60 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com