

分析 (1)水体富营养化是由于大量的氮、磷等元素排入到流速缓慢、更新周期长的地表水体,使藻类等水生生物大量地生长繁殖;
(2)CO与NO在催化剂条件下反应生成氮气和二氧化碳;
(3) 为厨余垃圾的标识;
为厨余垃圾的标识;
(4)垃圾焚烧时会产生一些有害气体如:二噁英(C12H4Cl4O2)、二氧化硫、氯化氢;
(5)在废水中加入NaClO溶液,将Ti+转变为Ti3+,则NaClO中氯由+1价降低为-1价;加入明矾能水解生成胶体,能吸附悬浮的杂质,常作混凝剂.
解答 解:(1)水体富营养化是由于大量的氮、磷等元素排入水体形成的,故答案为:N、P;
(2)CO与NO在催化剂条件下反应生成氮气和二氧化碳,化学方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2 ,故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2 ;
(3) 为厨余垃圾的标识,故答案为:c;
为厨余垃圾的标识,故答案为:c;
(4)含氯有机垃圾直接露天焚烧会产生一类剧毒有机物(含C、H、O、Cl),其名称为二噁英或二恶英;
故答案为:二噁英或二恶英;
(5)在废水中加入NaClO溶液,将Ti+转变为Ti3+,则NaClO中氯由+1价降低为-1价,为氧化剂;加入熟石灰,将Ti3+转变为难溶物Ti(OH)3,最后加入明矾沉降除去,明矾做混凝剂,
故答案为:氧化剂;混凝剂.
点评 本题主要考查了食品添加剂、材料以及常见的污染与治理,涉及知识点较多,掌握基础是解题关键.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:解答题

 .
. 也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是
也可与Ⅲ发生类似反应③的反应,生成有机物V,V的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH3 sp2 平面三角形 | B. | SO32- sp2 平面三角形 | ||
| C. | SO2 sp2 V形 | D. | NO3- sp3 三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应,碳酸氢钠产生的二氧化碳多 | |
| B. | 等物质的量的盐酸分别与足量的碳酸钠和碳酸氢钠反应,碳酸氢钠产生的二氧化碳多 | |
| C. | 相同温度在水中的溶解度:碳酸钠大于碳酸氢钠 | |
| D. | 用氢氧化钙溶液鉴别碳酸钠和碳酸氢钠两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
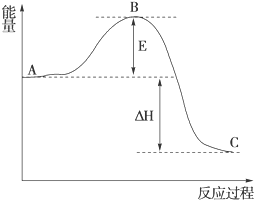 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+H2O(l)△H=-880kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0△S>0的反应均是自发反应 | |
| B. | 自发进行的反应一定能迅速进行 | |
| C. | 冰在室温下自动熔化成水,不是熵增的结果 | |
| D. | 非自发进行的反应一定不可能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com