
分析 (1)根据电荷守恒计算Al的物质的量,再根据m=nM计算Al的质量,进而计算氧化铝的质量,根据n=$\frac{m}{M}$计算氧化铝的物质的量;
(2)最终为硫酸铝溶液,由Al原子、硫酸根离子守恒可得n(H2SO4)=3n[Al2(SO4)3]=3×[$\frac{1}{2}$n(Al)+n(Al2O3)],进而计算硫酸的物质的量浓度;
(3)根据稀释定律计算;
(4)可能两种情况:一为沉淀不完全,发生反应Al3++3OH-═Al(OH)3↓,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,结合方程式计算消耗氢氧化钠物质的量.
解答 解:(1)氢气物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,根据电荷守恒,Al的物质的量为$\frac{0.3mol×2}{3}$=0.2mol,Al的质量为0.2mol×27g/mol=5.4g,氧化铝的质量为15.6g-5.4g=10.2g,氧化铝的物质的量为$\frac{10.2g}{102g/mol}$=0.1mol,
答:铝片中Al2O3为0.1mol;
(2)最终为硫酸铝溶液,由Al原子、硫酸根离子守恒可得n(H2SO4)=3n[Al2(SO4)3]=3×[$\frac{1}{2}$n(Al)+n(Al2O3)]=3×(0.2mol×$\frac{1}{2}$+0.1mol)=0.6mol,故硫酸的物质的量浓度为$\frac{0.6mol}{0.3L}$=2mol/L,
答:该稀硫酸的浓度为2mol/L;
(3)稀释前后溶质硫酸的物质的量不变,根据稀释定律,需要浓硫酸的体积为$\frac{300mL×2mol/L}{12mol/L}$=50.0mL,
答:需要12.0mol/L的浓硫酸为50.0mL;
(4)Al原子总物质的量为0.4mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.4mol×78g/mol=31.2g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,n[Al(OH)3]=$\frac{7.8g}{78g/mol}$=0.1mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.1mol×3=0.3mol,
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.4mol 1.3mol 0.4mol
Al(OH)3+OH-═AlO2-+2H2O
(0.4-0.1)mol (0.4-0.1)mol
则消耗的碱的物质的量为1.2mol+(0.4-0.1)mol=1.5mol,
答:需要加入氢氧化钠的物质的量为0.3mol或1.5mol.
点评 本题考查混合物的有关计算,题目难度中等,注意利用守恒法计算,(4)中关键是根据氯化铝与氢氧化铝的量判断发生的反应,侧重考查学生分析计算能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
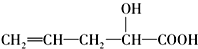 在不同条件下至少可能发生7中不同类型的有机反应,其中分子结构中的-OH可以发生的反应类型有( )
在不同条件下至少可能发生7中不同类型的有机反应,其中分子结构中的-OH可以发生的反应类型有( )| A. | ①③④ | B. | ③④⑤ | C. | ④⑤⑥⑦ | D. | ②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>Z>X | C. | Z>Y>X | D. | Y>X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时增大 | B. | 同时减小 | C. | v1增大,v2减小 | D. | v1减小,v2增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com