
【题目】金属铝分别和O2、O3发生反应生成Al2O3 , 反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。下列有关说法中不正确的是( )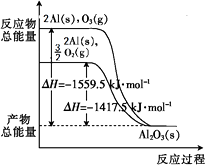
A.Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)=Al2O3(s) ΔH =-1559.5 kJ·mol-1
B.等质量的O2比O3的能量低
C.1 mol O2完全转化为O3 , 需吸收142 kJ的热量
D.给3O2(g) ![]() 2O3(g)的平衡体系加热,有利于O3的生成
2O3(g)的平衡体系加热,有利于O3的生成
【答案】C
【解析】A.根据图像, Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)=Al2O3(s) ΔH =-1559.5 kJ·mol-1 , A不符合题意;
B. 根据图像,2Al(s)+ ![]() O2(g)=Al2O3(s) ΔH =-1417.5 kJ·mol-1 , 结合A可知,
O2(g)=Al2O3(s) ΔH =-1417.5 kJ·mol-1 , 结合A可知, ![]() O2(g)
O2(g) ![]() O3(g) ΔH =+142 kJ·mol-1 , 等质量的O2比O3的能量低,B不符合题意;
O3(g) ΔH =+142 kJ·mol-1 , 等质量的O2比O3的能量低,B不符合题意;
C. 根据B的分析,1 mol O2完全转化为O3 , 需放出142 kJ的热量,C符合题意;
D. 3O2(g) ![]() 2O3(g)的正反应属于吸热反应,给平衡体系加热,温度升高,平衡正向移动,有利于O3的生成,D不符合题意;
2O3(g)的正反应属于吸热反应,给平衡体系加热,温度升高,平衡正向移动,有利于O3的生成,D不符合题意;
故答案为:CA.根据图像可直接得出反应ΔH 的值,从而得出该反应的热化学方程式;
B.根据图像,得出两个热化学方程式,根据盖斯定律,可确定 ![]() O2(g) O3(g)的ΔH , 从而确定O2和O3的能量大小;
O2(g) O3(g)的ΔH , 从而确定O2和O3的能量大小;
C.由C选项的分析,可知 ![]() O2(g) O3(g) ΔH =+142 kJ·mol-1;
O2(g) O3(g) ΔH =+142 kJ·mol-1;
D.反应为吸热反应,升高温度,平衡正移;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸广泛存在于苹果等水果的果肉中是一种常用的食品添加剂。经测定,草果酸的相对分子质量为134,所含各元素的质量分数为w(C)=35.82%,w(H)=4.48%、w(O)=59.70%。其中存在5种不同化学环境的H原子。以乙烯为原料人工合成草果酸的线路如图所示:
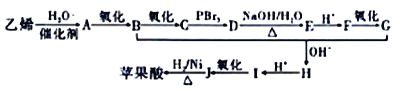
已知:①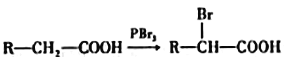
②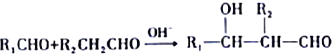
请回答下列问题:
(1)苹果酸的分子式为_______,B物质的名称为_______。F中含有的官能团名称是_______。
(2)G+B→H的反应类型是____________。I 的结构简式为___________________。
(3)D→E反应的化学方程式为________________________________。
(4)1mol苹果酸能与________molNaHCO3完全反应,能与足量的Na反应生成_______LH2(标况下)。
(5)与苹果酸含有相同种类和数量的官能团的同分异构体的结构简式为_________;其所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是__________(填序号)。
a. 元素分析仪 b.红外光谱仪 c. 质谱仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了解决目前存在的世界性能源危机,新的替代能源主要包括( )
①核能 ②柴草 ③焦碳 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气.
A.②③⑥⑦
B.①④⑤
C.③⑥⑦⑧
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式:S(l)+O2(g)![]() SO2(g)△H= -293.23kJ/mol,分析下列说法正确的是( )
SO2(g)△H= -293.23kJ/mol,分析下列说法正确的是( )
A. S(s)+O2(g)![]() SO2(g),反应放出的热量大于293.23kJ/mol
SO2(g),反应放出的热量大于293.23kJ/mol
B. S(s)+O2(g)![]() SO2(g),反应放出的热量小于293.23kJ/mol
SO2(g),反应放出的热量小于293.23kJ/mol
C. 1molSO2(g)的化学键断裂吸收的能量总和大于1molS(l)和1molO2(g)的化学键断裂吸收的能量之和。
D. 1molSO2(g)的化学键断裂吸收的能量总和小于1molS(l)和1molO2(g)的化学键断裂吸收的能量之和。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素在元素周期表中的位置如图所示。
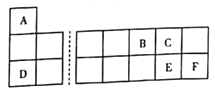
回答下列问题:
(1)在周期表中,E位于第_____________周期第_____________族。
(2)A、B能组成既含极性键又含非极性键的化合物,其电子式为_____________。
(3)在E、F的气态氢化物中,热稳定性较强的是_____________(填化学式,下同),还原性较强的是_______________。
(4)A、C、D、E组成两种酸式盐X、Y,将X、Y溶液混合发生复分解反应,写出离子方程式:________________________________________________________。
(5)常用(BA4)2E2C8检验废水中的Mn2+,若观察到无色溶液变紫红色,可判断废水中含Mn2+,还原产物与盐酸酸化的BaCl2溶液混合产生白色沉淀。写出无色溶液变紫红色溶液的离子方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获其原理如下图所示:
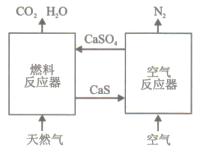
(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________(填“i”“ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________。
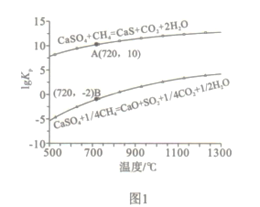
③下列措施可提高反应ii中甲烷平衡转化率的是_______。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
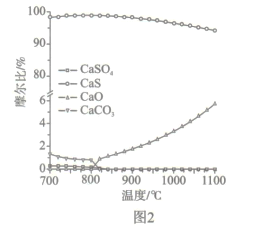
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:_______。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________反应。
②在天然气燃烧过程中,可循环利用的物质为________。
(4)该原理总反应的热化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如图,下列对该实验的描述错误的是( )
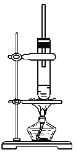
A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D. 图中装置不能较好的控制温度为115~125 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com