
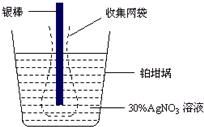
 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )| A. | 电量计中的银棒应与电源的正极相连,铂棒上发生的电极反应式为:2H++NO3-+e-=NO2↑+H2O | |
| B. | 已知每摩尔电子的电量为96 500 C,若反应进行10分钟,称量电解前后铂坩埚的质量变化值为108.0 mg,则电解过程中的平均电流约为9.65A | |
| C. | 若要测定电解精炼铜时通过的电量,可将银电量计中的银棒与待测电解池的精铜电极相连 | |
| D. | 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏低 |
分析 A、根据银电量计的电解原理判断电极反应;
B、测得铂坩埚增重,就能知道阳极有多少银被腐蚀,算出通过的电量,从而根据I=$\frac{q}{t}$计算出电解过程中的平均电流;
C、要测定电解精炼铜时通过的电量,应将两个电解池串联;
D、电解时阳极的银容易脱落到铂坩埚中.
解答 解:A、Ag的得电子能力强于硝酸根,铂棒上发生Ag++e-=Ag反应,故A错误;
B、析出Ag的物质的量为$\frac{108.0mg}{108.0g/mol}$=1mmol=0.001mol,根据Ag++e-=Ag可知通过电量为96.5库伦,根据I=$\frac{q}{t}$计算出电解过程中的平均电流为I=$\frac{96.5C}{10×60s}$≈0.161A,故B错误;
C、要将银电量计与电解精炼铜的电解池串联,才能做到通过的电量相同,电解精炼铜时,阳极为粗铜、阴极为精铜,将该银电量计中的银棒与待测电解池的精铜电极相连,铂坩埚接到电源的负极,故C正确;
D、银溶解时有些可能未失电子变成银离子然后在阴极(铂坩埚)得电子析出,而是直接跌落到铂坩埚中,造成铂坩埚增重较多,导致计算出的电量偏大,所以必须增加收集袋,故D错误.
故选C.
点评 本题考查电解原理的应用,关键是理解银电量计测定电量的工作原理,测量电量过程中应与其它电解池构成串联电路.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 都能和氢氧化钠发生中和反应 | B. | 都能与金属钠反应产生氢气 | ||
| C. | 都能与FeCl3溶液反应显紫色 | D. | 都属于酚类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨互为同位素 | |
| B. | 石墨不如金刚石稳定 | |
| C. | 金刚石比石墨能量低 | |
| D. | 等质量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)?C(金刚石)△H=+1.9kJ/mol可知,金刚石比石墨稳定 | |
| C. | 根据热化学方程式:S(s)+O2(g)?SO2(g)△H=-297.23kJ/mol,可推知1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和 | |
| D. | 根据稀溶液中反应:H+(aq)+OH-(aq)?H2O(l)△H=-57.3kJ/mol;若将含0.5 mol H2SO4的浓硫酸与含l mol NaOH的稀溶液混合时,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol | B. | 0.1 mol | C. | 0.2 mol/L | D. | 0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 溶液 | 离子组 |
| A | 滴加NaOH溶液可产生有刺激性气味的气体的溶液中 | K+、S2-、SO${\;}_{4}^{2-}$、NO3- |
| B | 有HCO${\;}_{3}^{-}$存在的溶液中 | Na+ K+、Cl-、AlO${\;}_{2}^{-}$ |
| C | pH=1的溶液中 | F-、Ca+、NO${\;}_{3}^{-}$、K+ |
| D | 能使紫色石蕊试液变红的溶液中 | Fe2+、MnO4-、NO${\;}_{3}^{-}$、SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | O | ||||||
| 3 | Na | Mg | Al | Si | S | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com