
| A. | 8 mol/L | B. | 9 mol/L | C. | 11 mol/L | D. | 12 mol/L |
分析 2.56g铜与一定量浓硝酸反应,铜完全溶解,反应生成气体的颜色逐渐变浅,得到的气体为NO和NO2,反应中硝酸起氧化剂与酸性作用,起酸性作用的硝酸生成Cu(NO3)2,起氧化剂作的硝酸得到NO和NO2,剩余硝酸的物质的量与氢氧化钠的物质的量相等,根据N原子守恒计算反应消耗的硝酸,再根据c=$\frac{n}{V}$计算浓HNO3物质的量浓度.
解答 解:2.56g Cu与一定量浓硝酸反应,Cu完全反应,反应生成气体的颜色逐渐变浅,得到的气体为NO和NO2,反应中硝酸起氧化剂与酸性作用,起酸性作用的硝酸生成Cu(NO3)2,起氧化剂作的硝酸得到NO和NO2,
根据N原子守恒,反应中作氧化剂的硝酸的物质的量=n(NO、NO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
反应中起酸作用硝酸的物质的量=2n[Cu(NO3)2]=2n(Cu)=2×$\frac{2.56g}{64g/mol}$=0.08mol,
剩余硝酸消耗NaOH的物质的量为:1mol/L×0.03L=0.03mol,则反应后剩余硝酸的物质的量为0.03mol,
所以原浓硝酸中含有硝酸的物质的量为:0.05mol+0.06mol+0.01mol=0.16mol,
则浓HNO3物质的量浓度为:$\frac{0.16mol}{0.02L}$=8mol/L,
故选A.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 该物质可能是金属钠 | B. | 该物质一定是钠的化合物 | ||
| C. | 该物质一定含钠元素 | D. | 该物质中可能含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
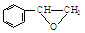 或
或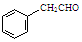 ,某种咔咯铁的配合物能将温室气体CO2转化为CO${\;}_{3}^{2-}$和CO.
,某种咔咯铁的配合物能将温室气体CO2转化为CO${\;}_{3}^{2-}$和CO.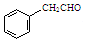 分子中碳原子轨道的杂化类型是sp2、sp3,1mol
分子中碳原子轨道的杂化类型是sp2、sp3,1mol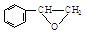 分子中含有σ键的数目为18mol.
分子中含有σ键的数目为18mol.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
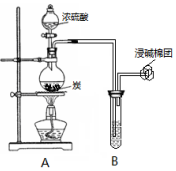 某小组同学利用如图装置开展实验,请回答:
某小组同学利用如图装置开展实验,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | S2-的结构示意图: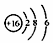 | |
| C. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | CO2的电子式 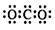 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
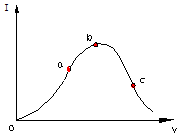 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mn2+的还原性弱于H2O2 | |
| B. | MnO4-是氧化剂,O2是氧化产物 | |
| C. | 生成lmol O2时,转移4 mol电子 | |
| D. | 离子方程式中按物质顺序的化学计量数是2、5、6、2、5、8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com