
在80 g密度为d g·cm-3的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中SO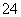 的物质的量浓度为(单位为mol·L-1)
的物质的量浓度为(单位为mol·L-1)
A.15d/16 B.5d/16 C.3d/8 D.5d/8
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
除去下列物质中所含的杂质(括号内为杂质),将选用的试剂和分离方法填在题后的横线上,并写出有关反应的离子方程式。
(1)Fe2O3[Fe(OH)3]______________________________;
(2)Fe2O3(Al2O3)_________________________________________________________;
(3)FeCl3(FeCl2)__________________________________________________________;
(4)FeCl2(FeCl3)___________________________________________________________;
(5)FeCl2(CuCl2)___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数。下列叙述正确的是 ( )
A.1mol甲醇中含有C-H键的数目为4NA
B.标准状况下,2.24L已烷含有分子的数目为0.1NA
C.12克金刚石中含有的共价键数目为2NA
D.1 mol 甲基所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
1.92gCu片与一定量的浓HNO3作用,当收集到NO2和
NO气体共1.12L时(标准状况),
金属铜恰好全部作用。则:
(1)反应中消耗HNO3 mol,转移电子 mol
(2)用排水法收集生成的气体,最后气体的体积为 L (标准状况)
(3)向收集到的气体中通入 mL O2(标准状况)才能使水刚好充满整个集气容器。
查看答案和解析>>
科目:高中化学 来源: 题型:
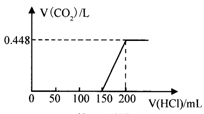
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2体积(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:(无需书写计算步骤)
(1)盐酸的物质的量浓度为 mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.用亚硫酸钠溶液处理纸浆中的残氯:SO32-+ 2OH-+ Cl2 = 2Cl-+ SO42-+ H2O
B.二氧化硫通入足量的溴水中:SO2 + Br2 +2H2O = 2HBr+2H++SO42-
C.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O
D.向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有____▲__性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+______▲____。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O +I2===S4O
+I2===S4O +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:

请回答:
①操作Ⅰ中反应的离子方程式是_____________▲_________________。
②确定操作Ⅱ完全反应的现象是_____________▲_________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_______▲___________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____▲____mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
A.1∶1 B.1∶2
C.2∶3 D.3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com