
【题目】下图是光合作用过程的图解,图中甲、乙、丙、丁表示能量或物质,①、②表示过程。据图回答:

(1)甲表示__________,它可转变为储存在丙中的__________。
(2)物质乙是__________,美国科学家鲁宾和卡门利用同位素标记法进行探究,证明了光合作用产生的乙全部来自__________。
(3)物质丁是__________,过程①叫做__________,过程②所需的还原剂是图中的__________。突然停止光照,短时间内叶绿体中C5的含量__________(填“增加”“不变”或“减少”)。
(4)写出光合作用的总反应式:______________________________。
(5)植物光合作用强度受多种环境因素的影响。冬季蔬菜大棚主要是通过改变__________来提高光合作用强度。为提高蔬菜产童,菜农常向大棚内施加有机肥以增加__________和__________的供应。
【答案】光能 活跃的化学能 O2 H2O C3 CO2的固定 [H] 减少 ![]() 温度 矿质元素 CO2
温度 矿质元素 CO2
【解析】
光合作用分为两个阶段进行,在这两个阶段中,第一阶段是直接需要光的称为光反应,第二阶段不需要光直接参加,是二氧化碳转变为糖的反过程称为暗反应。光合作用在叶绿体中进行,光反应的场所位于类囊体膜,暗反应的场所在叶绿体基质。光反应的发生需要叶绿体类囊体膜上的色素、酶参与。光反应与碳反应的反应式如表所示。
光反应 | 碳反应 |
水的光解:H2O→H++O2+e- | CO2的固定:CO2+RuBP→三碳酸 |
ATP的合成:ADP+Pi+能量→ATP | 三碳酸的还原:三碳酸→三碳糖 |
NADPH的合成:NADP++H++能量→NADPH | RuBP的再生:三碳糖→RuBP |
能量转化:光能→电能→ATP、NADPH中活跃的化学能 | 能量转化:ATP、NADPH中活跃的化学能→有机物中稳定的化学能 |
(1)甲表示光能,它可转变为储存在ATP中的活跃的化学能。
(2)物质乙是O2,来自于水的光解。
(3)物质丁是C3,过程①叫做CO2的固定,过程②所需的还原剂是图中的[H]。突然停止光照,短时间内三碳酸还原得到的三碳糖减少,再生成的RuBP(C5)减少。
(4)光合作用是以CO2和H2O为反应物,生物糖类(CH2O)和O2的反应。
(5)植物光合作用强度受多种环境因素的影响,如光照强度、CO2、温度等。冬季蔬菜大棚主要是通过改变温度来提高光合作用强度。为提高蔬菜产量,菜农常向大棚内施加有机肥以增加矿质元素和CO2的供应。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O〔三草酸合铁(Ⅲ)酸钾晶体〕是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂。下图是在实验室制备K3[Fe(C2O4)3]·3H2O的流程:
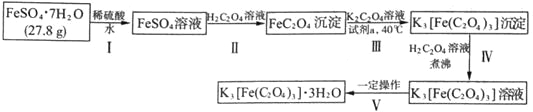
回答下列问题:
(1)步骤I中加入稀硫酸的目的是_______________。
步骤II中发生的主要化学反应为一可逆过程,其离子方程式为_______________。
常温下,该反应的平衡常数K=_______________[已知常温下:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]
(2)下列试剂均可将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”的是_______________(填序号)
a.氯水b.酸性KMnO4溶液c.H2O2溶液d.稀硝酸
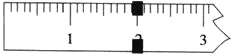
(3)使用托盘天平称量制得的K3[Fe(C2O4)3]·3H2O的质量。天平平衡时,右盘内砝码的总质量为20 g.游码示数如图所示,则制得晶体的质量为___________g,该实验中K3[Fe(C2O4)3]·3H2O的产率为_______________。(已知: K3[Fe(C2O4)3]·3H2O的相对分子质量为491,FeSO4·7H2O的相对分子质量为278)
(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用下图所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2。
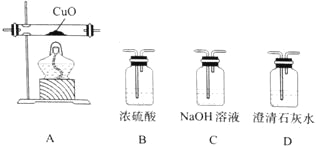
按气流从左到右的方向,装置的连接顺序为_______________(填装置序号) ;确认气体产物中含CO的现象为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下表是几种常见弱酸的电离平衡常数(25℃)
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是___;下列反应不能发生的是___(填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.CO32-+2HClO=CO2↑+H2O+2ClO-
c.ClO-+CH3COOH=CH3COO-+HClO
d.2ClO-+CO2+H2O=CO32-+2HClO
②碳酸钠溶液中各离子浓度从大到小的顺序依次为:___。
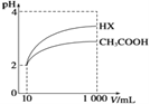
(2)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)__(填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);
(3)25℃时,向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__mol·L-1。
②完全沉淀后,溶液的pH=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液。
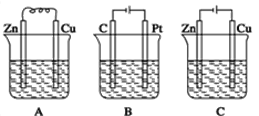
(1)A、B、C三个装置中属于原电池的是___(填标号)。
(2)A池中Zn是___极,电极反应式为___;A中总反应的离子方程式___。
(3)B池中总反应的方程式为___。
(4)C池中Zn是___极,发生___反应,电极反应式为___;反应过程中,CuCl2溶液浓度___(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是主要的化工产品。某课题组拟制备乙苯:查阅资料如下:
①几种有机物的沸点如下表:
有机物 | 苯 | 溴乙烷 | 乙苯 |
沸点/℃ | 80 | 38.4 | 136.2 |
②化学原理: ![]() +CH3CH2Br
+CH3CH2Br![]()
![]() +HBr。
+HBr。
③氯化铝易升华、易潮解。
I.制备氯化铝
甲同学选择下列装置制备氯化铝(装置不可重复使用):
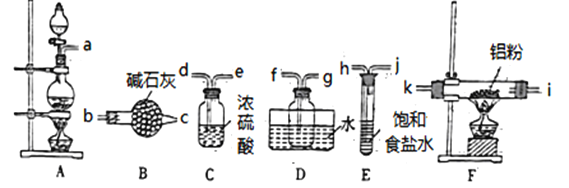
(1)本实验制备氯气的发生装置的玻璃仪器有________种。
(2)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当___________ 时(填实验现象)点燃F处酒精灯。
(3)气体流动方向是从左至右,装置导管接口连接顺序a→______→k→i→f→g→_____。
(4)D装置存在明显缺陷,若不改进,导致的实验后果是______________。
II.制备乙苯
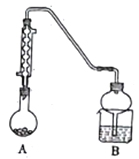
乙同学设计实验步骤如下:
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溴乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(5)本实验加热方式宜采用_______ (填“酒精灯直接加热”或“水浴加热”)。
(6)确认本实验A中已发生了反应的试剂可以是___。
A 硝酸银溶液 B 石蕊试液
C 品红溶液 D 氢氧化钠溶液
(7)提纯产品的操作步骤有:
①过滤; ②用稀盐酸洗涤; ③少量蒸馏水水洗 ④加入大量无水氯化钙;⑤用大量水洗; ⑥蒸馏并收集136.2℃馏分 ⑦分液。
操作的先后顺序为⑤⑦__ __⑦__ __⑥(填其它代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此废玻璃为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。

己知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)反应①的离子方程式________________________。
(2)反应②的离子方程武是_____________________________。
(3)为了得到较纯的Ce3+溶液,反应②之前要进行的操作是______
(4)反应③需要加入的试剂X可以是______________。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
![]()
用FeSO4溶液滴定用_____做指示剂,滴定终点的现象_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH及导电能力变化如图所示。下列叙述正确的是( )

A. MOH是强电解质 B. b点对应的盐不水解
C. 水的离子积Kw:b>c>a D. c点溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是 ( )
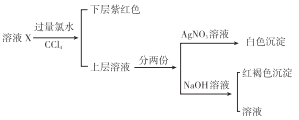
A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为_____;向该容器中补充amol炭,水蒸气的转化率将_____(填“增大”、“减小”或“不变”)。
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡_____移动( 填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___(填“变大”、“变小”或“不变”)。
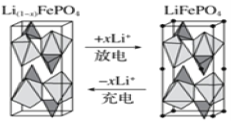
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com