
【题目】铜锌合金俗称黄铜.下列不易鉴别黄铜与真金的方法是( )
A.测密度B.测熔点C.灼烧D.看外观
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验并得到下表实验结果:
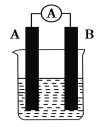
实验序号 | A | B | 烧杯中的液体 | 灵敏电流表指针是否偏转 |
1 | Zn | Zn | 乙醇 | 无 |
2 | Zn | Cu | 稀硫酸 | 有 |
3 | Zn | Cu | 稀硫酸 | 无 |
4 | Zn | Cu | 苯 | 无 |
5 | Cu | C | 氯化钠溶液 | 有 |
6 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述实验,回答下列问题:
(1)实验2中电流由________极流向________极(填“A”或“B”)。
(2)实验6中电子由B极流向A极,表明负极是________(填“镁”或“铝”)电极。
(3)实验5表明________(填字母序号,下同)。
A.铜在潮湿空气中不会被腐蚀
B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是________。
A.金属活动顺序表中,活泼性强的金属一定作负极
B.失去电子的电极是负极
C.烧杯中的液体必须是电解质溶液
D.原电池中,浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( ) 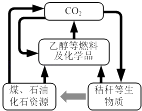
A.大力发展煤的气化及液化技术
B.加快石油等化石燃料的开采和使用
C.以CO2 为原料生产可降解塑料
D.将秸秆进行加工转化为乙醇燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Q与R的摩尔质量之比为9:22,在反应X+2Y===2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量之比为
A. 46∶9 B. 16∶9 C. 7∶3 D. 32∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体这两种分散系的根本区别是( )
A. 是否有丁达尔现象 B. 分散质微粒直径的大小
C. 能否透过滤纸或半透膜 D. 是否均一、稳定、透明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4![]() 2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 ΔH>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
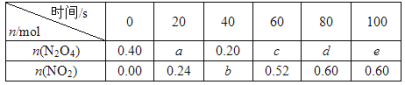
(1)计算20~40 s内用N2O4表示的平均反应速率为_________mol/( L s)。
(2)计算在80℃时该反应的平衡常数K=__________(请注明单位)。
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有_________(填序号)。
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
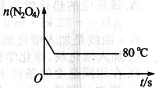
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是( )
A.长期放置的苯酚晶体变红B.硝酸银晶体光照后变黑
C.氢氧化亚铁变灰绿再变红褐D.二氧化氮气体冷却后变淡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com