
【题目】I. 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,其中W元素的原子结构示意图为 。
。
W | X | Y |
Z |
请回答下列问题:
(1)Z元素在元素周期表中的位置是__________________________________。
(2)X、Y、Z三种元素的原子半径由大到小的顺序为_________(元素符号表示)。
(3)X、Z、W三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序为________(用化学式表示)。
(4)用电子式表示WY2的形成过程__________________________________。
(5)写出W单质与浓硫酸反应的化学方程式_____________________________。
Ⅱ. A、B、C三种物质存在如图转化关系。
![]()
(6)若B为白色胶状不溶物,则A与C反应的离子方程式为_______________。
【答案】第三周期第VA族P>N>OHNO3>H3PO4>H2CO3![]() C+2H2SO4(浓)
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2OAl3++3A1O2-+6H2O==4Al(OH)3↓
CO2↑+2SO2↑+2H2OAl3++3A1O2-+6H2O==4Al(OH)3↓
【解析】
I.根据W元素的原子结构示意图可知b=2,则a=6,即W是C,所以X是N,Z是P,Y是O,则
(1)P元素在元素周期表中的位置是第三周期第VA族。
(2)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则X、Y、Z三种元素的原子半径由大到小的顺序为P>N>O。
(3)非金属性是N>P>C,非金属性越强,最高价含氧酸的酸性越强,因此X、Z、W三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序为HNO3>H3PO4>H2CO3。
(4)CO2是共价化合物,其形成过程可表示为![]() 。
。
(5)碳单质与浓硫酸反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
Ⅱ.(6)若B为白色胶状不溶物,则B是氢氧化铝,因此A与C是铝盐和偏铝酸盐,所以A与C反应的离子方程式为Al3++3A1O2-+6H2O=4Al(OH)3↓。


科目:高中化学 来源: 题型:
【题目】下图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
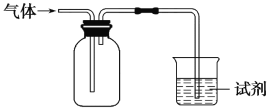
选项 | 气体 | 试剂 | 现象 | 结论 |
A | NO | 紫色石蕊溶液 | 溶液变红 | NO与水反应生成硝酸 |
B | Cl2 | 淀粉KI溶液 | 溶液变蓝 | Cl2有氧化性 |
C | SO2 | 品红溶液 | 溶液褪色 | SO2有强氧化性 |
D | NH3 | MgCl2溶液 | 产生白色沉淀 | NH3有碱性 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,则下列结论中正确的是

①铜为负极,锌为正极;②铜极上有气泡;③SO42-向铜极移动;④锌发生还原反应;⑤电子的流向是铜到锌;⑥负极反应式:Zn-2e-=Zn2+
A. ①②B. ①④⑥
C. ②④⑥D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸在下列转化中,既表现出氧化性又表现出酸性的是 ( )
A. Cu―→CuSO4 B. C―→CO2
C. Fe(OH)3―→Fe2(SO4)3 D. Fe2O3―→Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中,属于可逆反应的一组是( )
A. 2H2O![]() 2H2↑+O2↑,2H2+O2
2H2↑+O2↑,2H2+O2![]() 2H2O
2H2O
B. NH3+CO2+H2O=NH4HCO3,NH4HCO3![]() NH3↑+H2O↑+CO2↑
NH3↑+H2O↑+CO2↑
C. H2+I2![]() 2HI,2HI
2HI,2HI![]() H2↑+I2↑
H2↑+I2↑
D. 2Ag+Br2![]() 2AgBr,2AgBr
2AgBr,2AgBr![]() 2Ag+Br2
2Ag+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个石油化工发展水平的标志。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)A的官能团的名称是____________。C的结构简式是____________。
(2)E是一种具有香味的液体,由B + D→的反应方程式为:____________。该反应类型是____________。
(3)G是一种高分子化合物,其名称是____________,链节是____________。
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27OC)进行应急处理。写出由A制F的化学反应方程式:____________。决定F能用于冷冻麻醉应急处理的性质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
(1)下列说法中正确的是__(填序号).
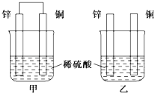
A.甲、乙均为化学能转变为电能的装置
B.甲中铜为正极,乙中铜为负极
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中的pH值均增大
(2)在相同时间内,两烧杯中产生气泡的速率:甲__乙(填“>”、“<”或“=”).
(3)写出甲池中负极反应的电极反应式为:_______________________________。
(4)当甲中产生3.36L(标准状况)气体时,理论上通过导线的电子数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在活性炭催化下,用CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料可生成橙黄色晶体X。为测定其组成,进行如下实验。
I、氨的测定:
精确称取13.375 g X配成1000 mL溶液,取出10.00 mL溶液,注入如图所示的三颈瓶(B)中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用20.00 mL 0.20 mol·L1的标准盐酸吸收。蒸氨结束后取下接收瓶,用0.20 mol·L1NaOH标准溶液滴定过剩的HCl,到终点时消耗5.00 mLNaOH溶液。

II、氯的测定:
准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,已知:Ag2CrO4为砖红色,Ksp(Ag2CrO4)=1.12×1012。
回答下列问题:
(1)仪器a的名称是_________测定氨前应该对装置进行__________,安全管的作用原理是_____________________________________________________。
(2)NaOH标准溶液应装入___式滴定管,C装置冰盐水的作用是_________。
(3)测定氯的过程中,使用棕色滴定管的原因是____________________;判断滴定终点的方法是___________________________________________________,若终点溶液中c(Ag+)=1.0×105 mol·L1,此时c(CrO42)为______ mol·L1。
(4)13.375 g样品X中氨的物质的量为_____ mol。
(5)经测定,样品X的化学式为Co(NH3)6Cl3,写出制备X的化学方程式:_________________;X的制备过程中,若温度过高X产率下降,原因是___________________。(写一点)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com