
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题 |
分析 A.绿色化学是无污染、无公害的化学,核心是利用化学原理从源头消灭污染;
B.Si可做为半导体,可以有很多特殊的功能,二氧化硅是光导纤维的主要成分;
C.胶体的微粒直径在1-100nm之间;
D.开发高效氢能、太阳能等新型电动汽车,可以减少污染性气体的排放,改善空气质量.
解答 解:A.绿色化学是对环境友好型化学,要求原料物质中所有的原子完全被利用且全部转入期望的产品中,原子的利用率100%,无污染、无公害的化学,核心是利用化学原理从源头消灭污染,故A错误;
B.Si原子最外层电子为4个,既难得电子,也难失去电子,可做为半导体,可用于制造硅芯片,是计算机芯片的成分,故B错误;
C.PM2.5是指大气中直径小于或等于2.5um的颗粒物,PM2.5的直径大于胶体直径,所以不属于胶体,故C错误;
D.氢能、核能、太阳能等是清洁能源,可减少污染,使用新型电动汽车,可减少城市机动车尾气排放,故D正确;
故选D.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,注意能形成胶体的微粒直径在1-100nm之间,为易错点,难度不大,注意绿色化学的核心高频考点.


科目:高中化学 来源: 题型:选择题
| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
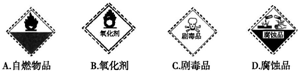
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
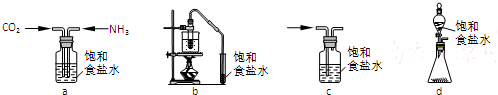
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
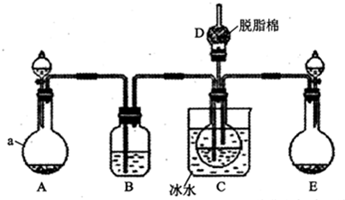

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 | B. | 还原性(碱性溶液):Fe(OH)2>I2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO>NaClO4 | D. | 酸性(水溶液):H2CO3>HSCN>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
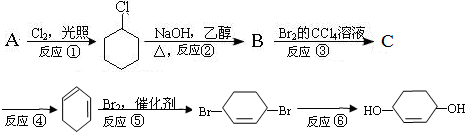
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com