
| A. | △H1<△H3 | B. | △H2>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2=△H3 |
分析 已知CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H1>0,CuSO4(s)=Cu2+(aq)+SO42-(aq)△H2<0,
CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(l)△H3,根据盖斯定律确定关系.
解答 解:已知CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H1>0 ①,
CuSO4(s)=Cu2+(aq)+SO42-(aq)△H2<0 ②,
根据盖斯定律①-②得到CuSO4•5H2O(s)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4(s)+5H2O(l)△H3=△H1-△H2,因为△H1>0,△H2<0 故△H1<△H3,△H2<△H3,故A正确;
故选A.
点评 本题考查了化学反应的焓变以及盖斯定律的运用,题目较简单.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 | |
| B. | 人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 | |
| C. | 长期烧水的水壶内壁容易形成一层水垢,可以用食醋除去 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
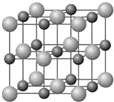 原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.
原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 22.4g | C. | 5.6g | D. | 56g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中加入等浓度等体积的盐酸:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | NaHS溶液中:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | pH相同的①CH3COONa溶液、②NaClO溶液中c(Na+):①<② | |
| D. | pH=9的0.1mol•L-1的NaHR溶液中:c(HR-)>c(H+)>c(R2-)>c(H2R) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
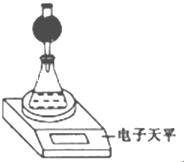 (3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.
(3)整个实验中应控制的不变量是硝酸溶液体积和CaCO3质量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
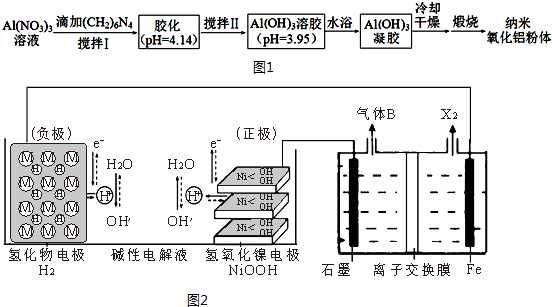
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com