
 ⑥
⑥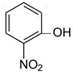 ⑦I2 ⑧H2O2 ⑨SiO2 ⑩NH4Cl
⑦I2 ⑧H2O2 ⑨SiO2 ⑩NH4Cl ⑥
⑥ ⑦I2 ⑧H2O2 为分子晶体,②H2O ⑤
⑦I2 ⑧H2O2 为分子晶体,②H2O ⑤ ⑥
⑥ ⑧H2O2 分子之间存在氢键,故气化还需要克服氢键;
⑧H2O2 分子之间存在氢键,故气化还需要克服氢键; ⑥
⑥ ⑧H2O2 分子之间存在氢键,故气化还需要克服氢键,故答案为:①③⑩;②⑤⑥⑧;
⑧H2O2 分子之间存在氢键,故气化还需要克服氢键,故答案为:①③⑩;②⑤⑥⑧; 的熔沸点比⑤
的熔沸点比⑤ 的熔沸点低,
的熔沸点低,

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
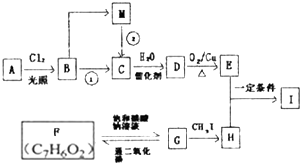
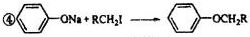
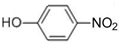
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙探究小组同学对铁及其化合物的性质进行了探究,试回答下列问题:
甲、乙探究小组同学对铁及其化合物的性质进行了探究,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图装置可验证同主族元素非金属性的变化规律
利用如图装置可验证同主族元素非金属性的变化规律| 题号 | 实 验 要 求 | 答案 |
| ① | 从碘水中提取碘单质 | |
| ② | 提纯混有少混NaCl的KNO3 | |
| ③ | 鉴别NaCl和KCl | |
| ④ | 检验自来水中残余氯分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com