
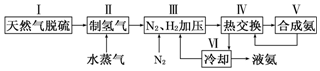
分析 (1)依据起始量氮气和氢气物质的量之比等于反应之比分析判断;反应是放热反应,升温平衡逆向进行;
(2)氯水是氯气的水溶液,其中氯气与水发生了反应,氯气与水的反应是可逆反应;
(3)反应①为吸热反应,升高温度,正向移动,氢气的百分量提高;依据平衡移动原理和影响反应速率因素分析判断;依据化学平衡三段式列式计算,根据转化率的表达式计算.
解答 解:(1)依据起始量氮气和氢气物质的量之比等于反应之比分析判断,在密闭容器中,使2molN2和6molH2混合发生反应,应物起始量之比等于化学方程式中的反应之比,所以平衡浓度为1:3;合成氨的反应为放热反应,升高温度,平衡向吸热方向移动,即逆方向,
故答案为:1:3; 逆向移动;
(2)氯水是氯气与水的混合液,其中氯气与水反应生成盐酸和次氯酸,该反应是可逆反应,离子反应为Cl2+H2O?H++Cl-+HClO,
故答案为:Cl2+H2O?H++Cl-+HClO;
(3)反应①是个体积增大的吸热反应,升高温度,反应速率加快,反应正向移动,氢气含量增多,a正确,增大压强平衡逆向移动,氢气含量降低,b错误,催化剂加快反应速率,但平衡不移动,c错误,降低压强,反应速率减慢,d错误,选a;
2mol CO和H2的混合气体(H2的体积分数为80%)中 H2为:2mol×80%=1.6mol,CO的物质的量为:0.4mol,与H2O反应,得到2.28mol CO、CO2和H2的混合气体,该反应前后气体体积不变,增加的部分应该是起始的水蒸气的物质的量为:2.28mol-2mol=0.28mol,设转化的一氧化碳的物质的量为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 0.4 0.28 0 1.6
变化量(mol) x x x x
平衡量(mol)0.4-x 0.28-x x x+1.6
则:0.4-x+x+x+1.6=2.28,
x=0.28mol
则CO转化率为:0.28mol/0.4mol×100%=70%,
故答案为:a;70%.
点评 本题考查了化学平衡影响因素、化学平衡的计算,题目难度中等,注意化学平衡的计算方法,明确化学平衡及其影响因素.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol•L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 标准状况下,11.2L H2中含有的电子数为1NA | |
| D. | O2的摩尔体积约为22.4 L•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
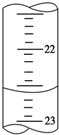 某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:
某课外活动小组欲用0.10mol/L的NaOH溶液滴定0.10mol/L的稀盐酸,其操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 26.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
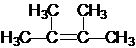 名称为2,3-二甲基-2-丁烯
名称为2,3-二甲基-2-丁烯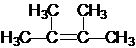 →
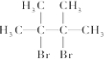
→
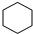 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com