


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
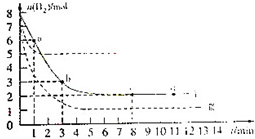 随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.
随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.查看答案和解析>>
科目:高中化学 来源: 题型:
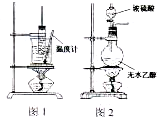
| A、用图1所示装置进行乙酸乙酯水解 |
| B、用图2所示装置实验室制取乙烯 |
| C、碘水用CCl4萃取分液后再蒸馏,可得到I2 |
| D、梨形分液漏斗检漏,加水后玻璃旋塞处是否漏水即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
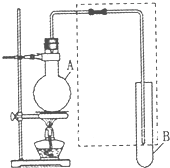 如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置.请
如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置.请查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com